| Verbindung | x | Name |
| W40O119 | WO2.975 | α-WOx |
| W50O148 | WO2.96 | Grenze zu α |
| W20O58 | WO2.90 | β-WOx |
| W18O49 | WO2.72 | γ-WOx |
Ein sehr ähnliches Bild ergibt sich für die Mo-Oxide, wie die folgende Tabelle 4.3. zeigt.
| Phasen | x | Struktur |
| α-MoOx | 3.00 - 2.95 | Schichtstruktur |
| β-MoOx | 2.75 - 2.65 | |
| γ-MoOx | 2.00 - 1.97 | Rutil |
Hier sind die Strukturen stöchiometrischer Phasen zwischen der α- und der β-Phase bekannt (Tab. 4.4.).
| Verbindung | x |
| Mo9O26 | MoO2.89 |
| Mo8O23 | MoO2.875 |
| Mo17O47 | MoO2.76 |
Dazu gibt es etliche gemischte Mo-W-Oxide mit komplizierten Zusammensetzungen.
Alle Zusammensetzungen und Strukturen lassen sich als Scherstrukturen von ReO3 erklären. In allen Oxiden liegt M in oktaedrischer Koordination vor. Die Zahl der gemeinsamen Kanten zwischen den MO6-Oktaedern kann einen weiten Bereich der Zusammensetzung erklären und reicht von TiO (( NaCl-Typ, acht gemeinsame Kanten) über TiO2 (Anatas, vier gemeinsame Kanten) und V2O5 (zwei gemeinsame Kanten) schließlich bis zum ReO3 (keine gemeinsamen Kanten). Die W-, Mo- und Nb-Oxide liegen zwischen den beiden letzten Zusammensetzungen M2O5 und MO3. Entsprechend lassen sich ausgehend von ReO3 durch Einführung sogenannter kristallographischer Scherungen entlang bestimmter Richtungen und in bestimmnten Abständen (diese führt zu mehr Kantenverknüpfung = abnehmendem O-Gehalt = mehr M5+) die Strukturen und Zusammensetzung dieser Phasen erklären:
Die Tabelle 4.5. zeigt zunächst Beispiele für Scherungen in nur eine Richtung hk0.
| Scherung | Richtung (hk0) | Formel | Beispiel | |
| A | 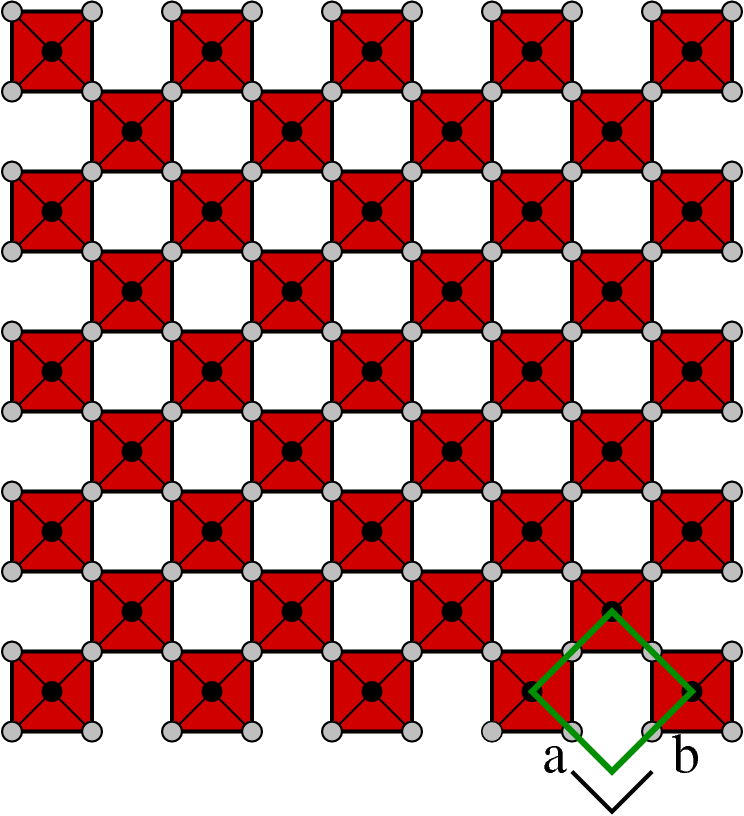 |
(000) | MO3 | ReO3 |
| B | 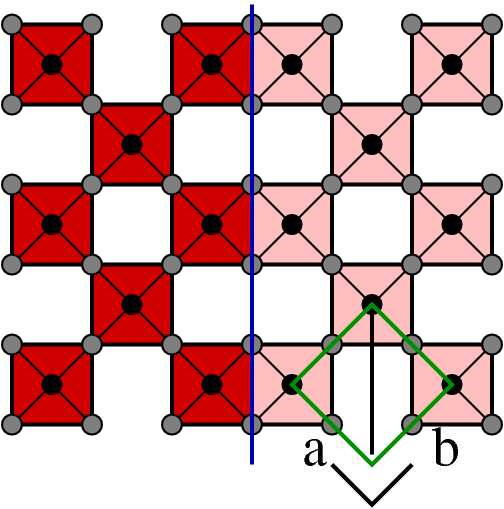 |
(110) | MO3 | keine |
| C | 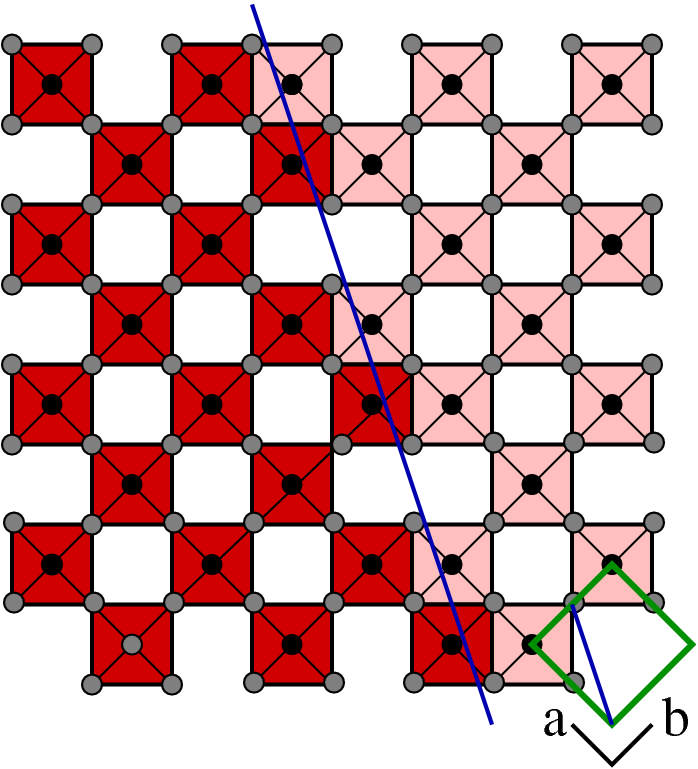 |
(120) | MnO3n-1 |  Mo8O23 |
| D | 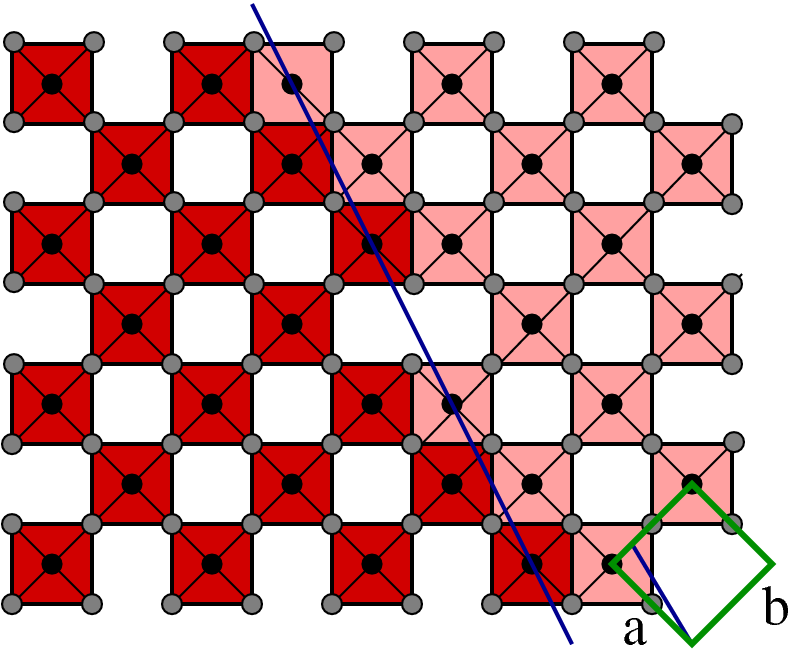 |
(130) | MnO3n-2 | W20O58, W50O148 |
| E | 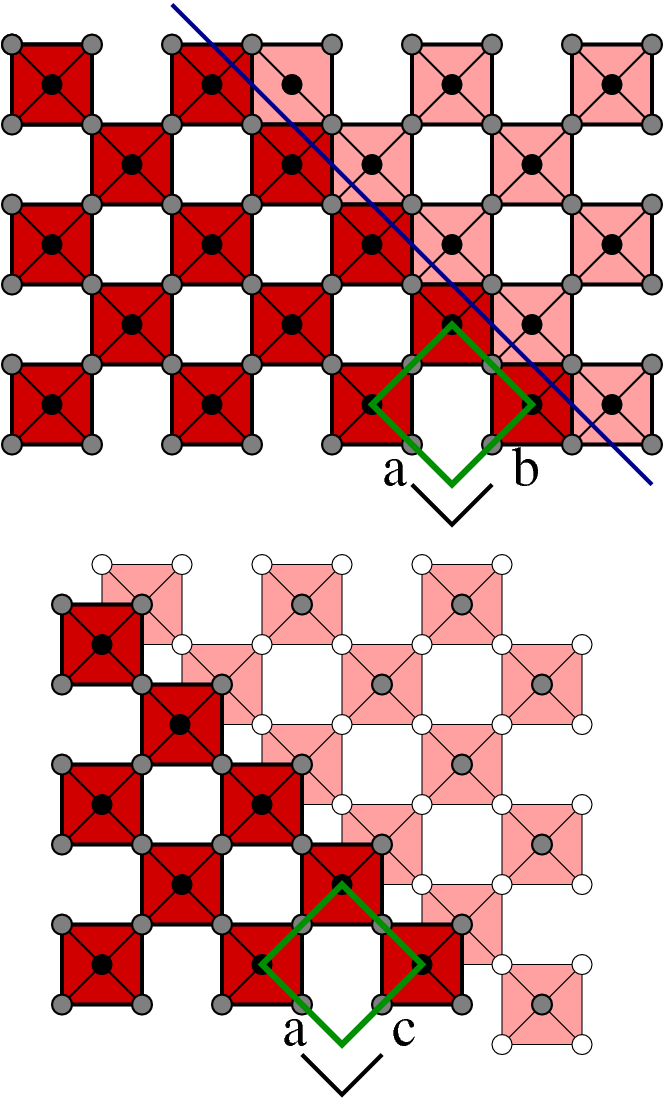 |
(010) | MmO3m-1 | 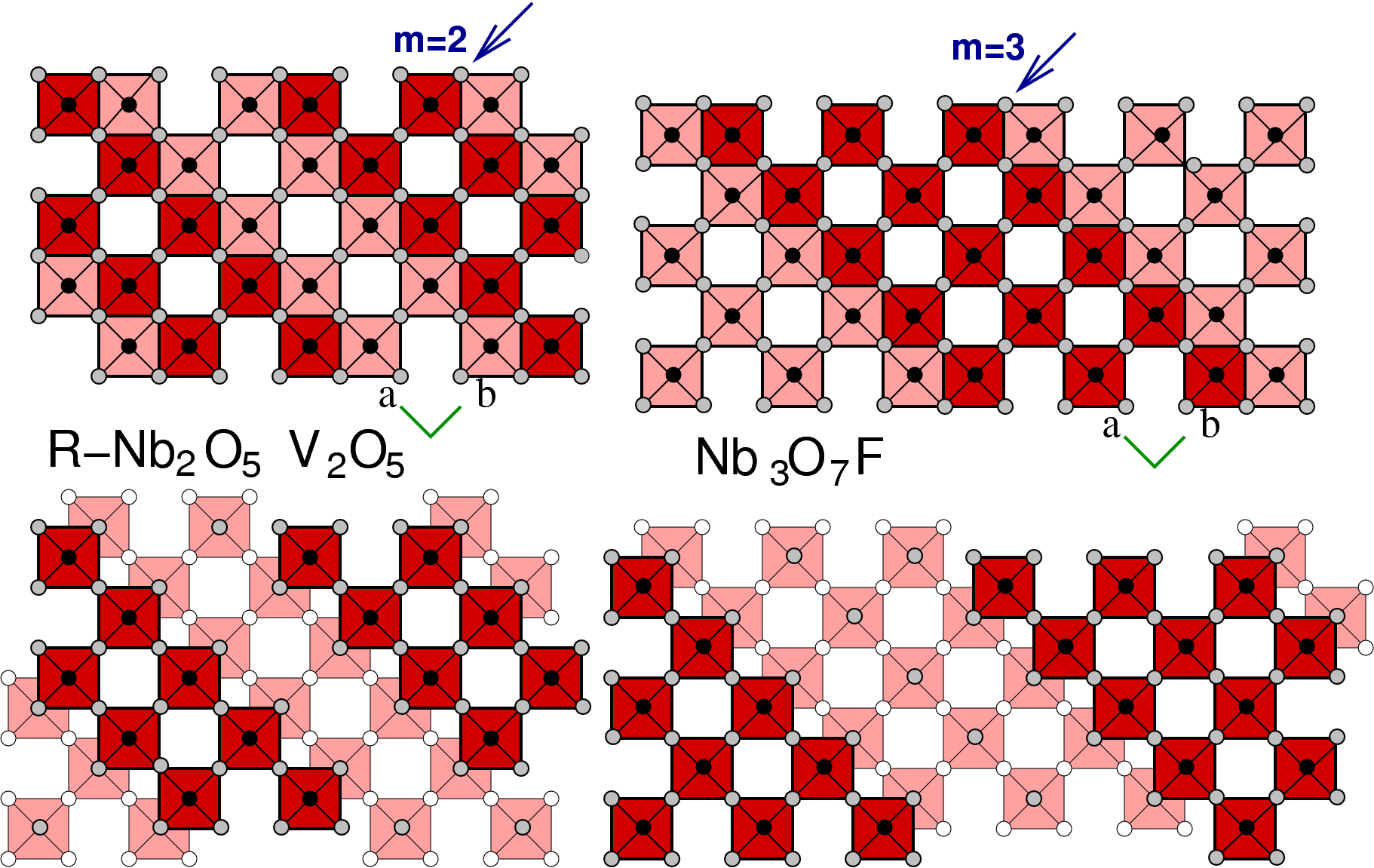 |
Im Einzelnen zu Tabelle 4.5.:
- A: Die Basis für alle weiteren Strukturen ist der ReO3-Typ, hier als Projektion auf eine der kubischen Achsen. Nach oben und unten liegt weitere Eckverknüpfung der Oktaeder vor.
- B: Die einfachste mögliche Scherung verläuft über die Flächendiagonale der Elementarzelle der ReO3-Struktur, die Richtung (1 1 0). Beispiele für diese Scherungen kommen NICHT vor! Die Stöchiometrie würde MO3 bleiben.
- C: Durch Scherung entlang (1 2 0) entstehen entlang der Scherrichtung MO6-Oktaeder mit zwei und einer gemeinsamen Kante. Die Stöchiometrie dieser Serie ist MnO3n-1 oder ganz allgemein bei Vorgabe der Scherrichtung MnO3n-(k-l). Hierbei ist n die Zahl der eckverknüpften Oktaeder in (1 0 0). Beispiel: Mo8O23; Weitere Vertreter dieser Serie: sind Mo9O26 und W40O119 und die ganze Serie (W,Mo)nO3n-1 mit n=8,9,10,11,12,14 und wechselndem W/Mo-Verhältnis.
- D: Scherung entlang (1 3 0) ergibt wieder die Zusammensetzungen MnO3n-(k-h) = MnO3n-2. Einzige Vertreter sind hier W50O148 und W20O58.
- E: Die weitere Fortsetzung dieser Art der Scherung führt schließlich auf (1 k 0) mit k gegen ∞, d.h. auf die Richtung (0 1 0). Dadurch ergibt sich eine neue Serie von Scherstrukturen, die vor allem bei V- und Nb-Oxiden auftritt. Die allgemeine Formel für diese Phasen ist MmO3m-1 wobei jetzt m die Zahl der eckverknüpften Oktaeder in (0 1 0) bezeichnet. Beispiele sind (m = 2) V2O5, R-Nb2O5 und (m = 3) Nb3O7F.
Eine ganze Serie weiterer Oxide läßt sich durch zwei solcher Scherung,
die senkrecht zueinander verlaufen, erklären
(sog. Block- oder besser Säulenstrukturen).
Der einfachste Fall ist jeweils eine Scherung in (1 0 0) und eine in (0 1 0),
so dass Säulen aus ReO3-Einheiten bestehen bleiben. An den Blockgrenzen
findet sich auch Kantenverknüpfung von Okatedern.
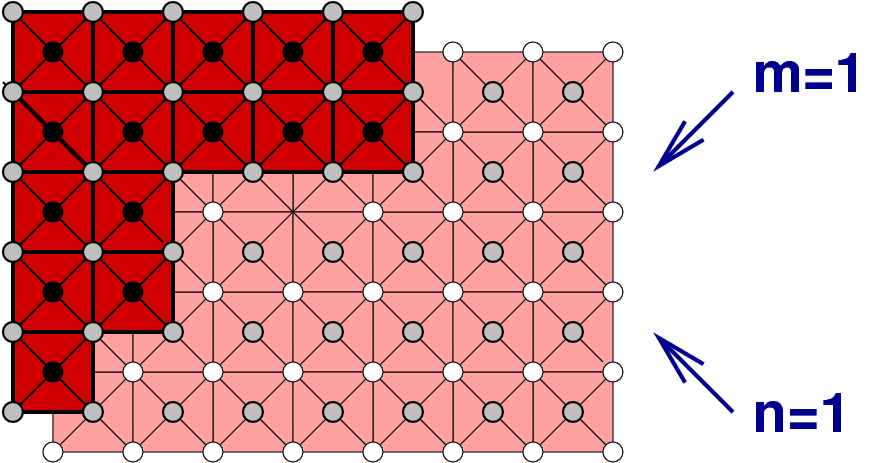
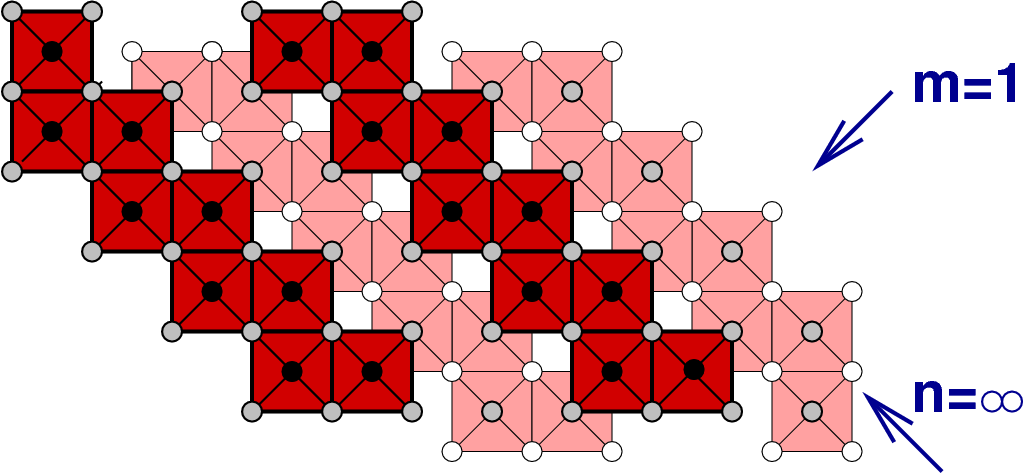
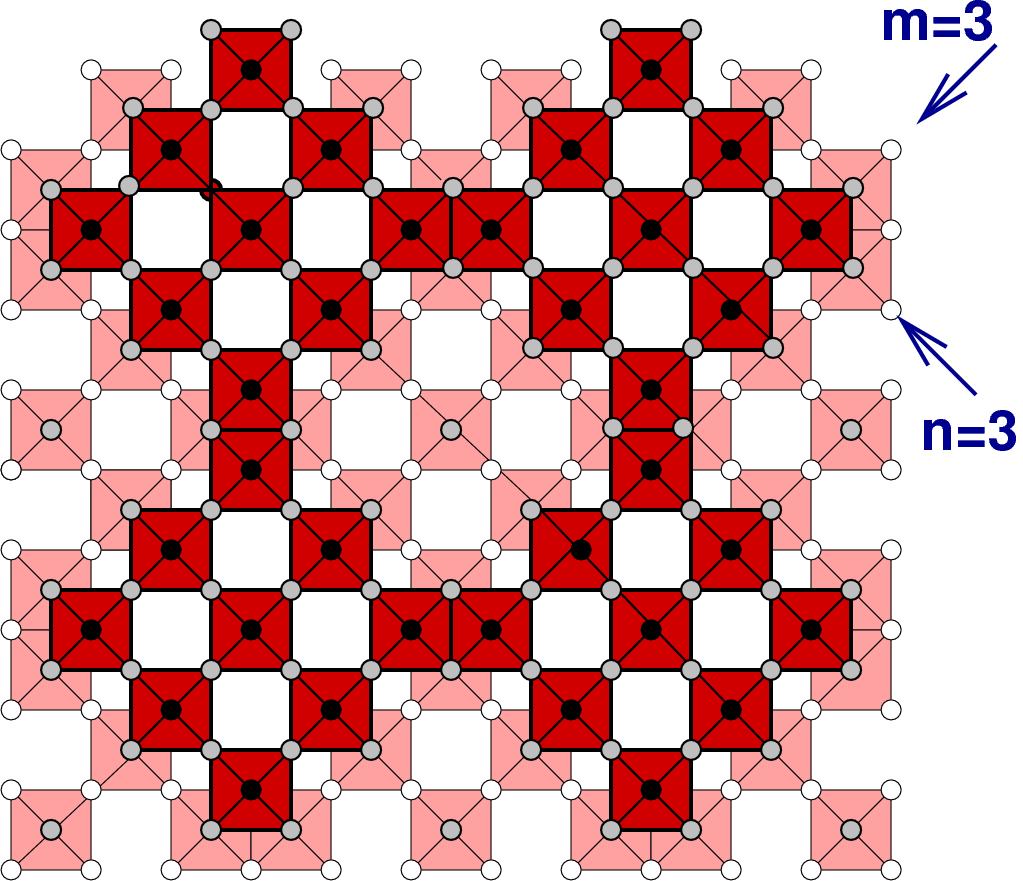
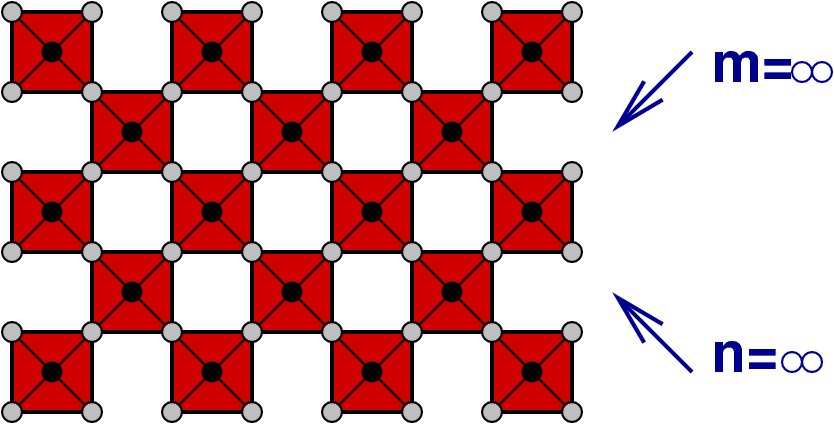
In die allgemeine Formel
| x in MOx | Blockgrösse | Stöchiometrie | Beispiele |
| 2.33 | 3 x 3 | M9O21 = M3O7 | TiNb2O7, TiTa2O7 |
| 2.417 | 3 x 4 | M12O36-7 = M12O29 | Nb12O29, Ti2Nb10O19 |
| 2.5 | 4 x 4 | M16O3*16-8 = M16O40 = M2O5 | M-Nb2O5 |
| 2.5 | ∞ x 2 | M2 ∞O6 ∞ -(∞ + 2) = M2O5 | R-Nb2O5, V2O5 |
| 2.67 | ∞ x 3 | M 3 ∞ O 9 ∞ - (∞ + 3) = M3O8 | Nb3O7F |
| 3 | ∞ x ∞ | M∞ ∞O3 ∞ ∞-(∞+2) = MO3 | ReO3 |
Die folgende tabellarische Übersicht (Tab. 4.7.) zeigt, dass diese Phasen zwischen NaCl (alle Kanten gemeinsam, Strukturtyp) und ReO3 (keine gemeinsame Kanten) liegt.
Diese Formel geht in die für die eindimensionale Scherung der gleichen Art über, wenn ein Index unendlich gesetzt wird. Wenn die Blöcke in beide Richtungen ∞-groß sind, muß letztlich wieder der ReO3-Typ resultieren.
Neben diesen einfachen Blockstrukturen gibt es noch eine riesige Zahl weiterer Scherstrukturen, bei denen die Blöcke in komplizierterer Weise verknüpft sind und andere allgemeine Formeln resultieren. Weitere Variationen entstehen durch Einbau von Elementen in die Tetraederlücken, die dann bevorzugt die Blockecken besetzen (z.B. PNb9O25).
Echte Nichtstöchiometrie kommt bei Verbindungen dieser Art zustande, wenn nicht-periodische Scherungen vorliegen.
Die Strukturaufklärung solcher Phasen ist röntgenographisch äußerst kompliziert, da der überwiegende Teil der Struktur ReO3 entspricht und für die eigentliche Strukturbestimmung die sehr schwachen Überstrukturreflexe ausgewertet werden müssen. Heute werden die Strukturen solcher Phasen mit großem Erfolg mit Hilfe von hochauflösender Elektronenmikroskopie aufgeklärt.
Im letzten Kapitel folgt nach den vielen komplizierten Stöchiometrien eine Betrachtung der Strukturchemie ternärer Oxide mit einer gleichbleibenden Zusammensetzung.
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |