| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
Vorlesung Chemie der Nichtmetalle6. Pnicogene (Pentele): N, P, As6.4. Chalkogenide |
 |
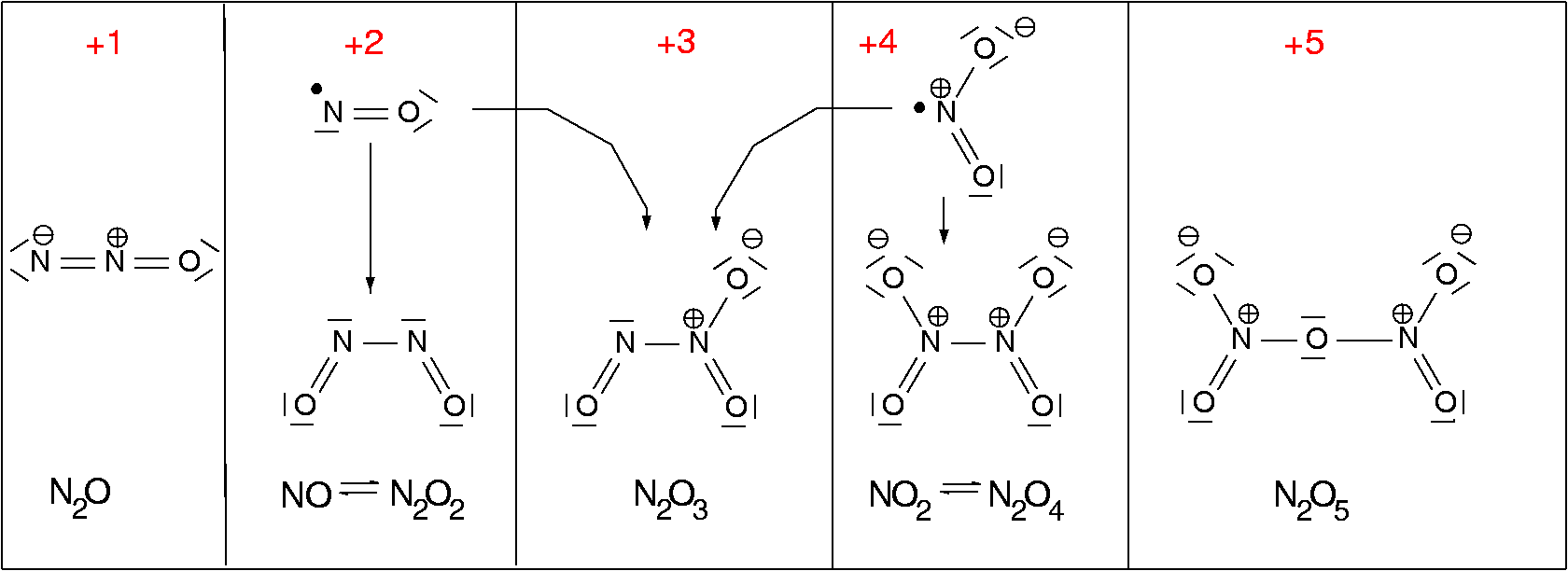
| Abb. 6.4.1. Valenzstrichformeln von N-Oxiden ‣SVG |
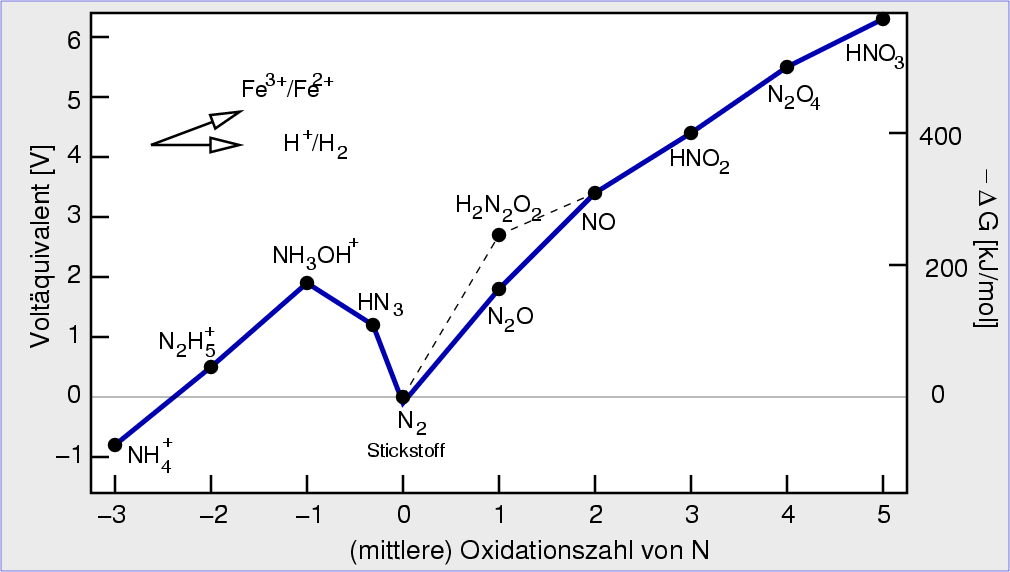 |
| Abb. 6.4.2. Frostdiagramm von N-O-Spezies ‣SVG |
|
|
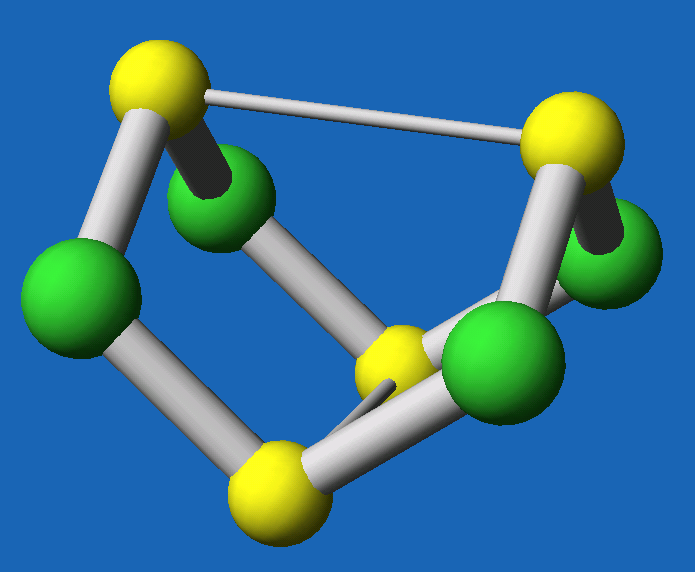
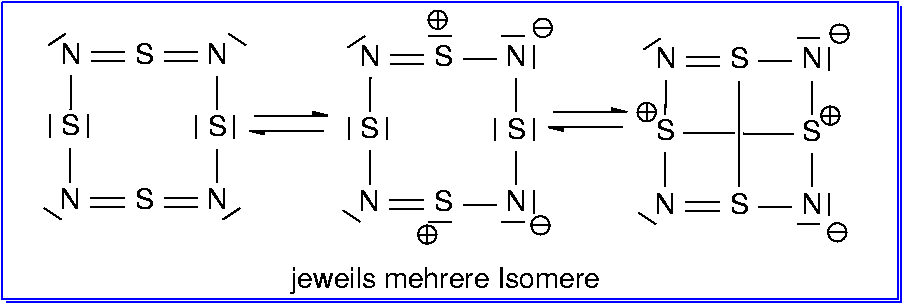
| Abb. 6.4.3. S4N4 ‣VRML | Abb. 6.4.4. Valenzstrichformeln für S4N4 ‣SVG |
|
|
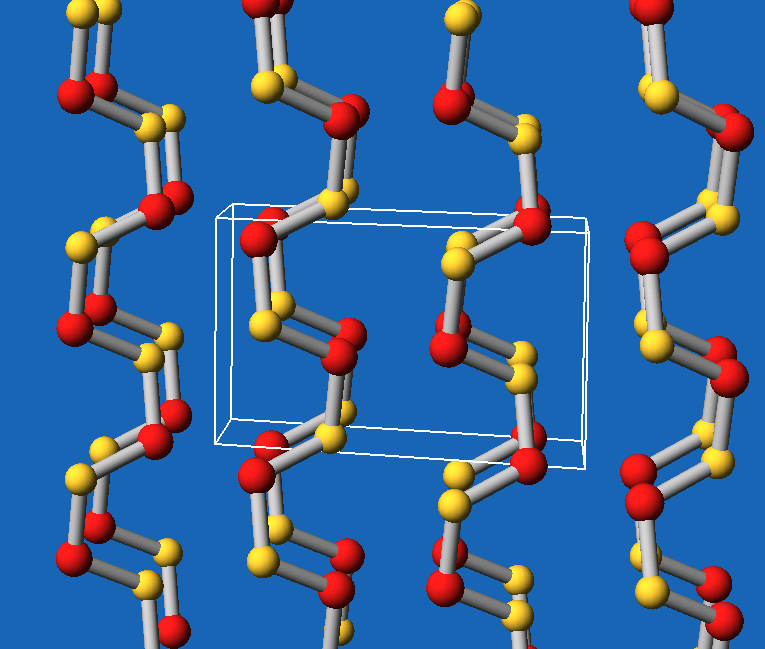
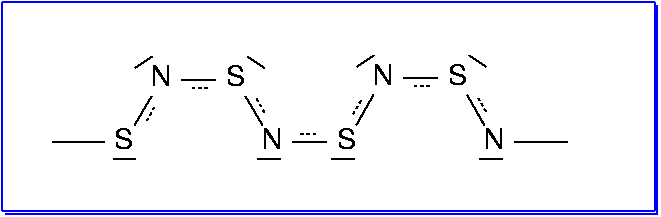
| Abb. 6.4.5. Kristallstruktur von SNx ‣VRML | Abb. 6.4.6. Valenzstrichformel für SNx ‣SVG |

|
| Abb. 6.4.7. Auswahl weiterer S-N-Verbindungen ‣SVG |
Die Verbindungen und Strukturen im Einzelnen:
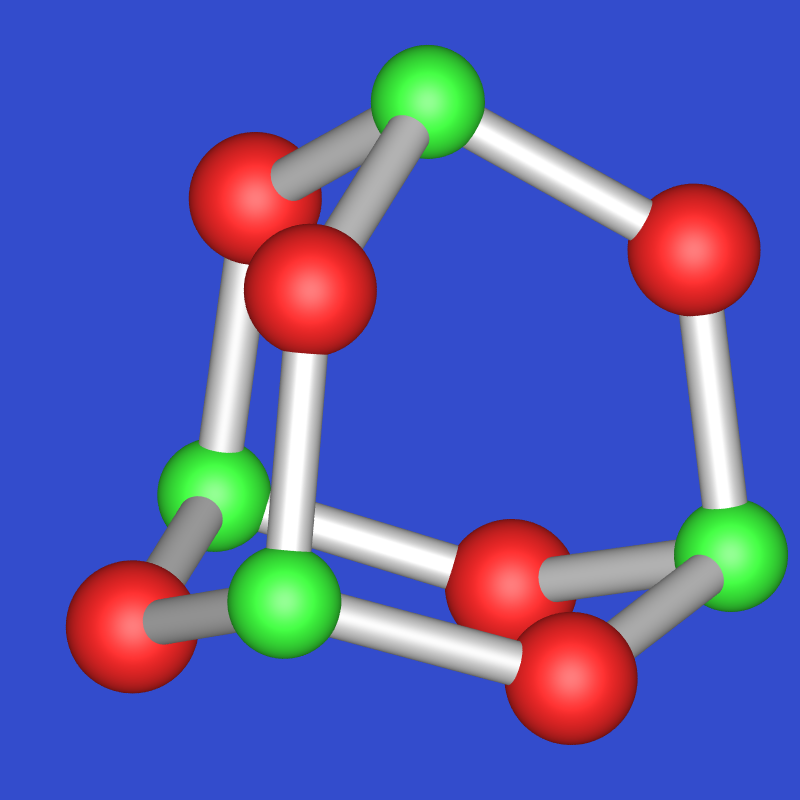 die Substanz bildet weiche, weiße Kristalle mit einem Schmelzpunkt von nur
24 oC und einem Siedepunkt von nur 175 oC und ist in organischen Lösungsmitteln
löslich.
Die Darstellung erfolgt durch Umsetzung von weißem Phosphor mit elementarem
Sauerstoff bei 50 oC und 0.1 bar. Wie bereits aus den physikalischen Eigenschaften
ersichtlich, liegt ein Molekülkristall mit isolierten
P4O6-Molekülen
vor, die formal aus P4 durch Einschub von Sauerstoffatomen in jede der
sechs Bindungen des Tetraeders aufgebaut werden kann.
Die Umgebung der P-Atome ist nahezu ideal tetraedrisch, die
P-O-Abstände liegen mit Werten von 164 pm zwischen Einfach- (P-O: 176 pm)
und Doppelbindungen (P=O : 156 pm). Der P-O-P-Winkel ist entsprechend mit 126 o
deutlich größer als der Tetraederwinkel.
die Substanz bildet weiche, weiße Kristalle mit einem Schmelzpunkt von nur
24 oC und einem Siedepunkt von nur 175 oC und ist in organischen Lösungsmitteln
löslich.
Die Darstellung erfolgt durch Umsetzung von weißem Phosphor mit elementarem
Sauerstoff bei 50 oC und 0.1 bar. Wie bereits aus den physikalischen Eigenschaften
ersichtlich, liegt ein Molekülkristall mit isolierten
P4O6-Molekülen
vor, die formal aus P4 durch Einschub von Sauerstoffatomen in jede der
sechs Bindungen des Tetraeders aufgebaut werden kann.
Die Umgebung der P-Atome ist nahezu ideal tetraedrisch, die
P-O-Abstände liegen mit Werten von 164 pm zwischen Einfach- (P-O: 176 pm)
und Doppelbindungen (P=O : 156 pm). Der P-O-P-Winkel ist entsprechend mit 126 o
deutlich größer als der Tetraederwinkel.
Tab. 6.4.1. gibt eine Übersicht zur Darstellung und Struktur der verschiedenen Modifikationen
von P4O10 (von oben nach unten nimmt die Hydrolysebeständigkeit der Modifikationen zu!)
| Modifikation | Umwdl. | Mp (Sbp.) [oC] | Dichte [g/cm3] | GIF | Strukturbeschreibung | |
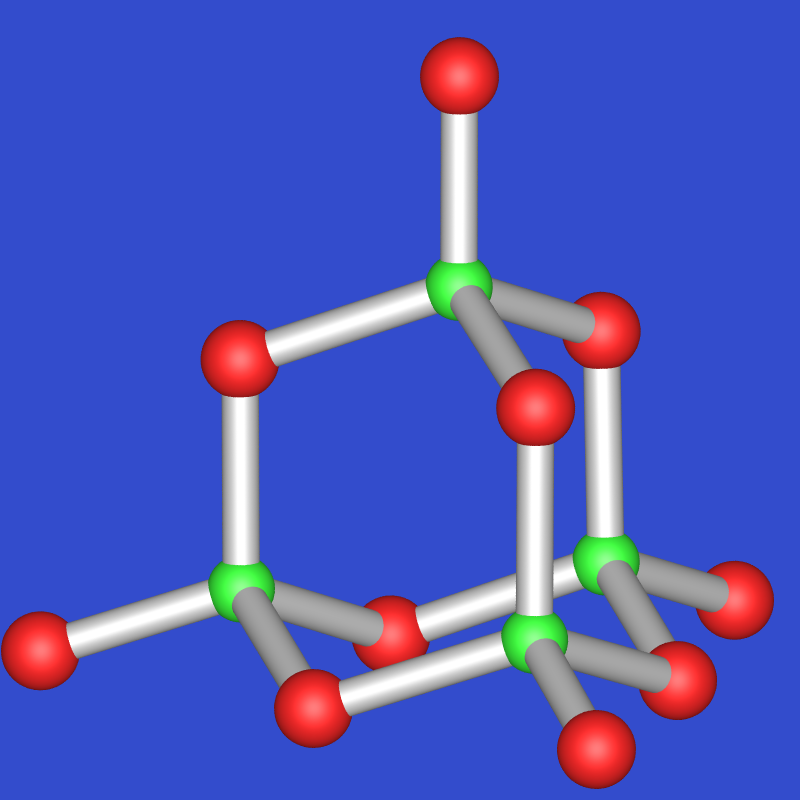
| H-P4O10 (hex.) | 420 (360) | 2.3 | metastabil |
|
Molekülkristall, verschiedene Modifikationen, formal weißer P+O | |
| 24 h, 400 oC | ||||||
| flüssig | ||||||
| Glas | ||||||
| 450 oC | ||||||
| O'-P2O5 (ortho.) | 562 | 2.72 | metastabil |
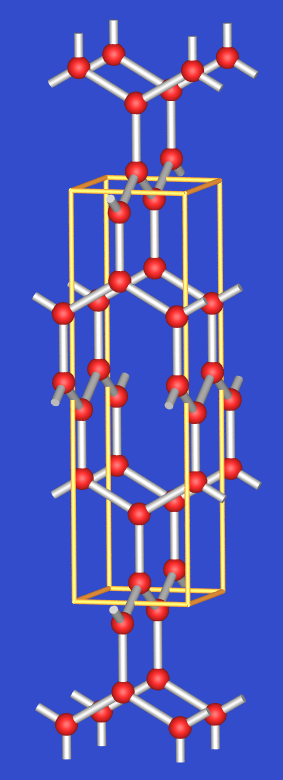
|
3D-Verband, Ringe aus 10 PO4-Tetraedern, P wie Si in ThSi2 | |
| 450 oC | ||||||
| O-P2O5 (ortho.) | 580 | 2.74 | stabil |

|
Schicht aus Ringen; isoelektronisch zu Blattsilicaten [Si2O5]2-; formal schwarzer P+O |
Es können dabei zwei kristalline Phasen unterschieden werden:
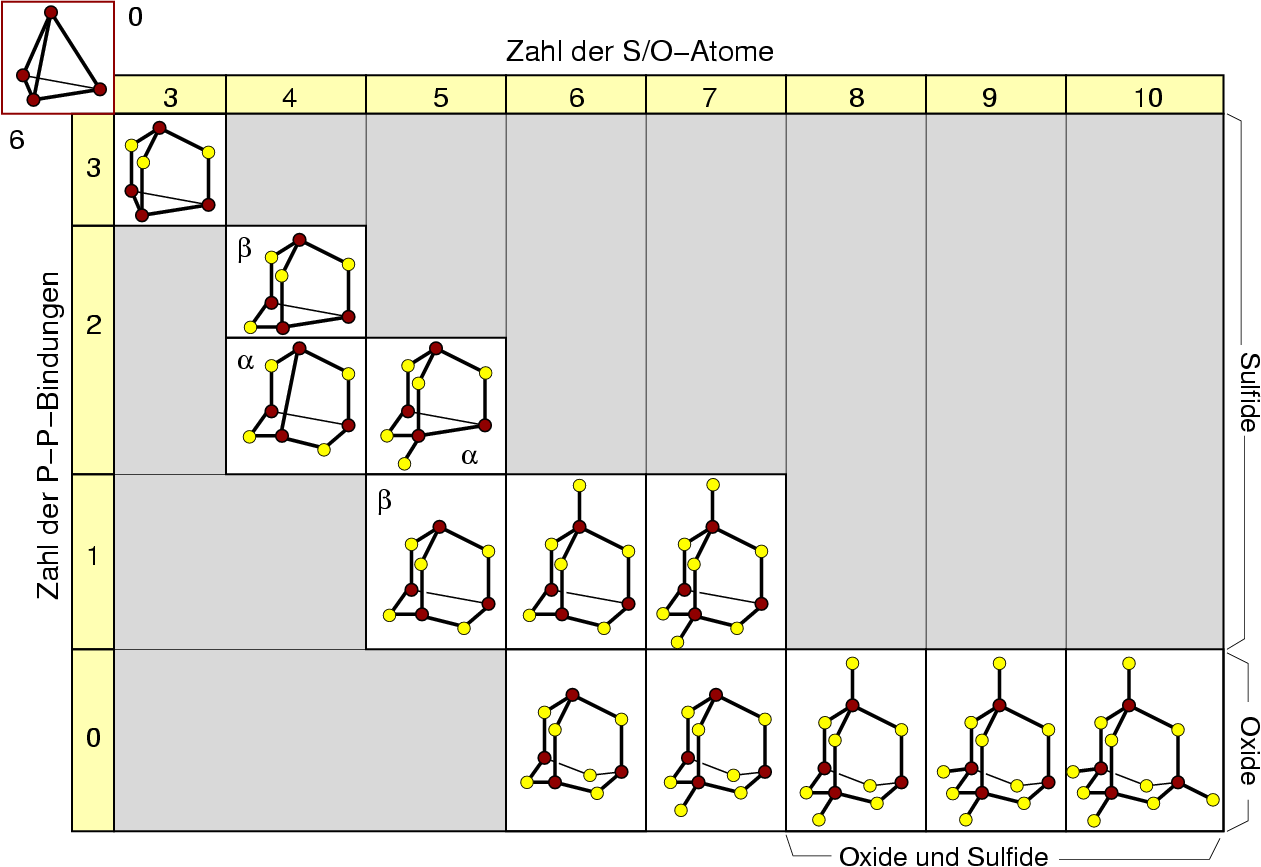 |
| Abb. 6.4.8. Phophor-Oxide und -Sulfide ‣SVG |
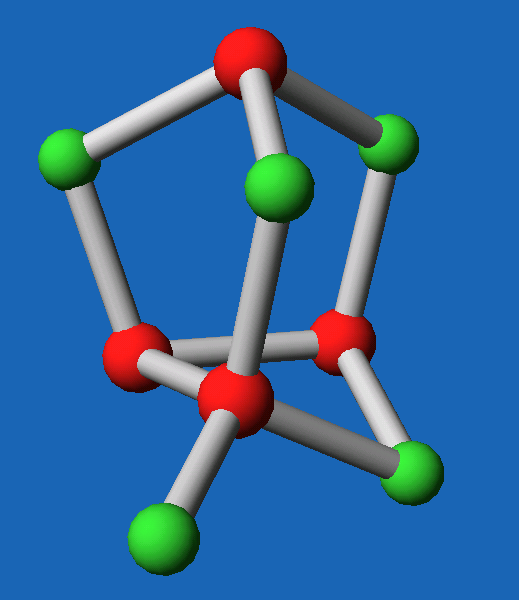
|

|
| Abb. 6.4.9. Kristallstruktur von P4S3 ‣VRML | Abb. 6.4.10. Kristallstruktur von P4S10 ‣VRML |
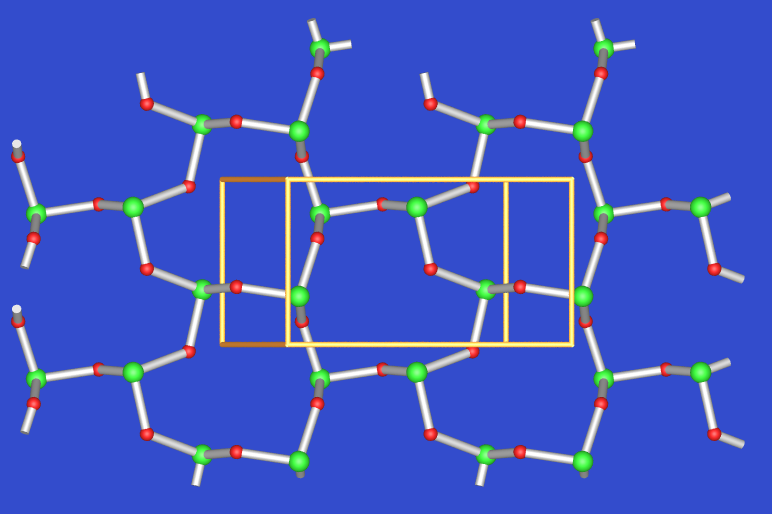 |
 |
| 6.4.11. Struktur von As2O3 (Claudetit) ‣VRML | 6.4.12. Struktur von As2O5 ‣VRML |
 |
| 6.4.12. Realgar (rot) und Auripigment (gelb) |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |