Vorlesung Strukturchemie der Oxide
2. Binäre kovalente Oxide, Nichtmetalloxide (nach
Hauptgruppen)
Die Oxide des Stickstoffs sind typische Molekülverbindungen, die bei
ausreichender Abkühlung Molekülkristalle bilden, bei denen die Gasstruktur
im wesentlichen erhalten bleibt.
Die Unterschiede zwischen N und P entsprechen denen zwischen C und Si
(Art der Doppelbindung, EN-Differenzen).
Die Oxide des Phosphors bilden eine strukturchemisch recht vielfältige
Verbindungsklasse. Die Oxidationsstufen in den Oxiden können zwischen V und/oder III
variieren. P4O6 und H-P4O10 sind echte Molekülkristalle (zwischen
denen sogar eine Mischkristallreihe aus Molekülen zwischen
P4O6 und P4O10 auftritt), die O-Formen von
P4O10 sind dagegen hochkondensierte Modifikationen
mit Schicht- bzw. Raumnetzstrukturen.
Die Verbindungen und Strukturen im Einzelnen:
P4O6
PIII4O6 ist das Anhydrid der phosphorigen
Säure. Die Struktur im Festkörper ist noch nicht sehr lange bekannt, denn
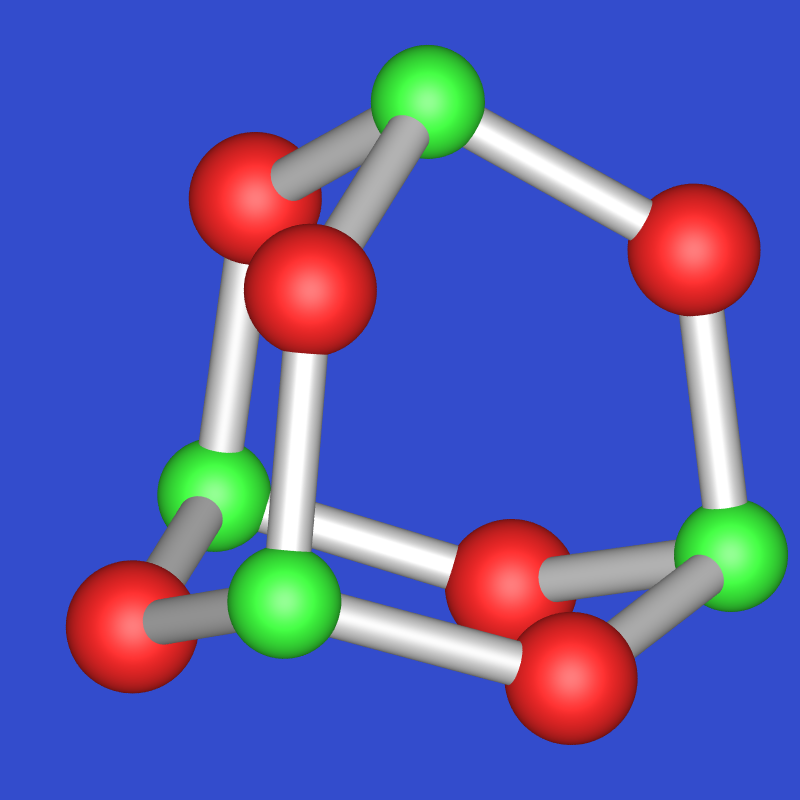 die Substanz bildet weiche, weiße Kristalle mit einem Schmelzpunkt von nur
24 oC und einem Siedepunkt von nur 175 oC.
Die Darstellung erfolgt durch Umsetzung von weißem Phosphor mit elementarem
Sauerstoff bei 50 oC und 0.1 bar. Wie bereits aus den physikalischen Eigenschaften
ersichtlich, liegt ein Molekülkristall mit isolierten
P4O6-Molekülen
vor, die formal aus P4 durch Einschub von Sauerstoffatomen in jede der
sechs Bindungen des Tetraeders aufgebaut werden kann.
Die Umgebung der P-Atome ist nahezu ideal tetraedrisch, die
P-O-Abstände liegen mit Werten von 164 pm zwischen Einfach- (P-O: 176 pm)
und Doppelbindungen (P=O : 156 pm). Der P-O-P-Winkel ist entsprechend mit 126 o
deutlich größer als der Tetraederwinkel.
die Substanz bildet weiche, weiße Kristalle mit einem Schmelzpunkt von nur
24 oC und einem Siedepunkt von nur 175 oC.
Die Darstellung erfolgt durch Umsetzung von weißem Phosphor mit elementarem
Sauerstoff bei 50 oC und 0.1 bar. Wie bereits aus den physikalischen Eigenschaften
ersichtlich, liegt ein Molekülkristall mit isolierten
P4O6-Molekülen
vor, die formal aus P4 durch Einschub von Sauerstoffatomen in jede der
sechs Bindungen des Tetraeders aufgebaut werden kann.
Die Umgebung der P-Atome ist nahezu ideal tetraedrisch, die
P-O-Abstände liegen mit Werten von 164 pm zwischen Einfach- (P-O: 176 pm)
und Doppelbindungen (P=O : 156 pm). Der P-O-P-Winkel ist entsprechend mit 126 o
deutlich größer als der Tetraederwinkel.
Von P4O10, dem Anhydrid der Phosphorsäure,
sind insgesamt drei kristalline Modifikationen bekannt, die alle aus
PO4-Tetraedern, die je über drei Ecken verknüpft sind, aufgebaut sind.
Diese Modifikationen sind ein schönes Beispiel
für gleiche Tetraeder mit identischer Verknüpfung, die
entweder zu 0- (Moleküle), 2- (Schichten) oder 3- (Raumnetz) dimensionalen
Verbänden führt.
Übersicht zu Darstellung und Struktur der verschiedenen Modifikationen von
P4O10
(Von oben nach unten nimmt die Hydrolysebeständigkeit zu)
| Modifikation |
Umwdl. |
Mp (Sbp.) [oC] |
Dichte [g/cm3] |
|
GIF |
Strukturbeschreibung |
| |
|
|
|
|
|
| H-P4O10 (hex.) |
|
420 (360) |
2.3 |
metastabil |
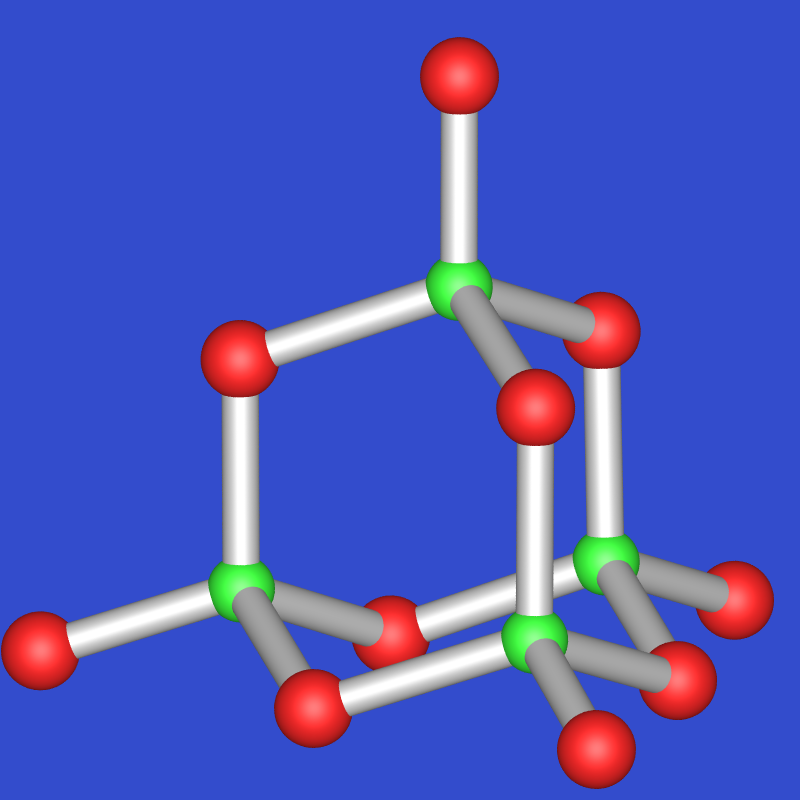
|
Molekülkristall, verschiedene Modifikationen, formal weißer P+O |
| |
24 h, 400 oC |
|
|
|
|
| flüssig |
|
|
|
|
|
| Glas |
|
|
|
|
| |
450 oC |
|
|
|
|
| O'-P2O5 (ortho.) |
|
562 |
2.72 |
metastabil |
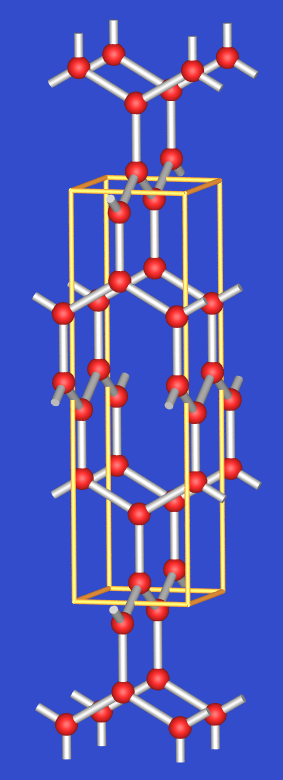
|
3D-Verband, Ringe aus 10 PO4-Tetraedern, P wie Si in ThSi2 |
| |
450 oC |
|
|
|
|
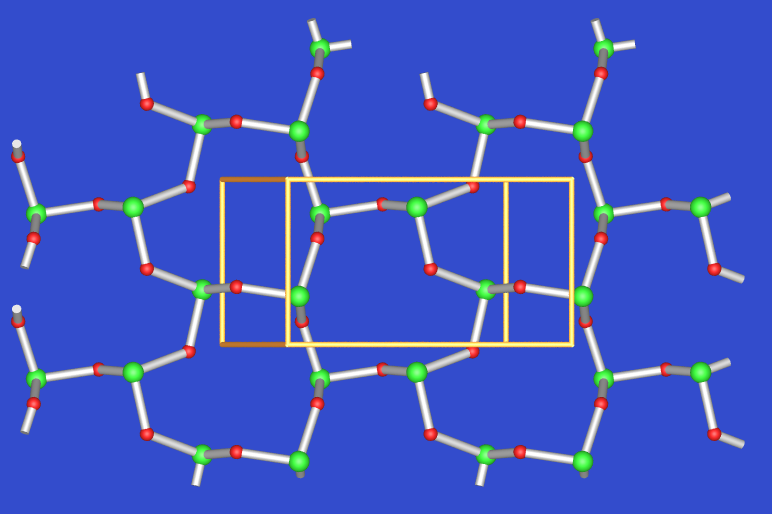
| O-P2O5 (ortho.) |
|
580 |
2.74 |
stabil |

|
Schicht aus Ringen; isoster zu Blattsilicaten [Si2O5]2-;
formal schwarzer P+O |
Neben den reinen PIII und PV-Oxiden gibt es
gemischte Oxide , die entsprechend
zwischen P4O6 und P4O10 liegen.
Die Moleküle P4Ox sind für x=7,8 und 9 bekannt,
jedoch nicht in reiner kristalliner Substanz, sondern
als 'gemischte Oxide', d.h. als feste Lösungen ineinander.
Die Kristallstrukturen zeigen entsprechend P4O6-Grundgerüste
mit statistischer Besetzung der terminalen (exocyclischen) O-Positionen.
Es können 2 kristalline Phasen unterschieden werden:
- Die alpha-Phase liegt im Zusammensetzungsbereich zwischen P4O8.1 und
P4O9.2 und stellt eine Mischung aus P4O8
und P4O9 dar.
D.h. diese beiden Moleküle können im Kristall über den angegebenen Bereich
ersetzt werden, ohne daß sich dabei die Packung ändert.
- Kristalle der beta-Form liegen im Bereich von P4O7.7 bis
P4O8
und sind analog eine Mischung von P4O7 und
P4O8, wiederum in statistischer Verteilung.
Zusätzlich zu den beschriebenen Oxiden ist mit P2O6
auch ein (allerdings nicht näher charakterisiertes violettes) Peroxid
O2P-O-O-PO2 bekannt,
das aus P4O10 und O2 bei elektrischer Entladung
dargestellt werden kann.
Wie für Hauptgruppenelemente zu erwarten überwiegt beim Arsen im Gegensatz
zum Phosphor die Oxidationsstufe +III:
AsIII2O3 (Arsenik) neigt zwar zur
Glasbildung, trotzdem sind aber zwei verschiedene kristalline Modifikationen bekannt.
Die kubische Hochtemperaturform Arsenolith (Arsenikblüte, Hüttenrauch)
schmilzt bei 278 oC. Die Struktur enthält Moleküle wie P4O6.
Unterhalb von 110 oC wandelt sie sich in die monokline Tieftemperaturform,
den Claudetit (Abb. 2.6.1.) um, der
bei 313 oC schmilzt. Die Struktur besteht aus hexagonalen
Sauerstoff-verbrückten As-Netzen, kann damit also ebenfalls aus der Elementstruktur
durch Einschub von Sauerstoff in alle As-As-Bindungen abgeleitet werden.
Die As-O-Abstände betragen 180 pm, der Winkel O-As-O 100 o.
 |
 |
| 2.6.1. Struktur von
As2O3 (Claudetit) |
2.6.2. Struktur von
As2O5 |
As2O5
besteht nicht wie P4O10 aus Molekülen, sondern ist hochmolekular aufgebaut.
Die recht komplexe Struktur
enthält die Kationen As5+ nebeneinander in
tetraedrischer (CN=4) und oktaedrische Koordination (CN=6).
Dies erscheint insofern verständlich, als die Verbindung
sauerstoffärmer als 2:6 = 1:3 ist, der Fall des ReO3-Typs
mit allseits eckverknüpften Oktaedern, so daß die Zusammensetzung
2:5 nur durch Kantenverknüpfung von Oktaedern erreicht werden kann.
Die AsO6/2-Oktaeder (nur Oktaeder: Zusammensetzung 1:3 z.B. in
ReO3) und AsO4/2-Tetraeder
(nur Tetraeder: Zusammensetzung 1:2 z.B. in SiO2)
sind über alle Ecken miteinander verknüpft, so daß
röhrenförmige Hohlräume entstehen (s. Abb. 2.6.2.).
Wie bei den As-Oxiden ist die Oxidationsstufe III deutlich stabiler als +V.
Ein reines kristallines Sb5+-Oxid ist nicht bekannt.
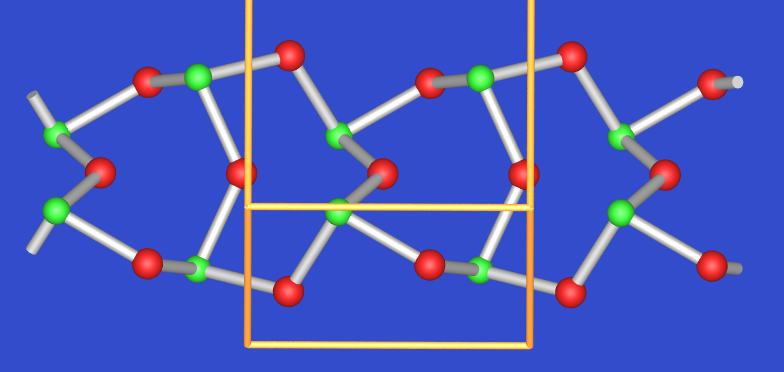
SbIII2O3 bildet zwei kristalline Modifikationen:
Die Tieftemperaturform, der
Valentinit , wird in
Analogie zum entsprechendem Sulfid (Grauspießglanz = Sb2S3)
Weißspießglanz oder auch Antimonblüte genannt.
Die Dichte beträgt 5.8 g/cm3, die Struktur besteht aus Bändern
psi-tetraedrisch koordinierter SbIII-Atome. Die Sb-O-Abstände
betragen 200 pm, der Winkel am Sb liegt zwischen 81 und 99 o.
Die kubische Hochtemperaturform, der Senarmonit
(Dichte 5.2 g/cm3) besteht aus Molekülen analog zu P4O6.
Senarmonit läßt sich unterhalb von 606 oC in Valentinit überführen.
 |
 |
| 2.6.3. Struktur von
Sb2O3 |
2.6.4. Struktur von
Sb2O4 (Cervantit) |
Das gemischtvalenten SbIII-SbV-Oxid
Sb2O4 (Cervantit), ein
feinkörniges, gelbes Mineral,
läßt sich (jeweils bei Temperaturen von ca. 800 oC)
entweder durch Reduktion von Sb2O5 oder durch Oxidation von
Sb2O3 herstellen.
Cervantit ist isotyp zu SbNbO4 und besteht aus Schichten leicht verzerrter
SbVO6-Oktaeder. Die Oktaederschichten entsprechen den
NiF6-Oktaederschichten im K2NiF4-Typ.
Die Schichten sind durch SbIII-Atome verknüpft, die
psi-bipyramidal (Lone-Pair!) von Sauerstoff koordiniert sind.
Die Oxide von Bismut zeigen deutlich ausgeprägteren ionischen Charakter.
Z.B. bildet die δ-Modifikation von Bi2O3 eine Defektvariante des CaF2-Typs
mit Fehlstellen im Anionenverband, gemäß Bi2O3_.
 die Substanz bildet weiche, weiße Kristalle mit einem Schmelzpunkt von nur
24 oC und einem Siedepunkt von nur 175 oC.
Die Darstellung erfolgt durch Umsetzung von weißem Phosphor mit elementarem
Sauerstoff bei 50 oC und 0.1 bar. Wie bereits aus den physikalischen Eigenschaften
ersichtlich, liegt ein Molekülkristall mit isolierten
P4O6-Molekülen
vor, die formal aus P4 durch Einschub von Sauerstoffatomen in jede der
sechs Bindungen des Tetraeders aufgebaut werden kann.
Die Umgebung der P-Atome ist nahezu ideal tetraedrisch, die
P-O-Abstände liegen mit Werten von 164 pm zwischen Einfach- (P-O: 176 pm)
und Doppelbindungen (P=O : 156 pm). Der P-O-P-Winkel ist entsprechend mit 126 o
deutlich größer als der Tetraederwinkel.
die Substanz bildet weiche, weiße Kristalle mit einem Schmelzpunkt von nur
24 oC und einem Siedepunkt von nur 175 oC.
Die Darstellung erfolgt durch Umsetzung von weißem Phosphor mit elementarem
Sauerstoff bei 50 oC und 0.1 bar. Wie bereits aus den physikalischen Eigenschaften
ersichtlich, liegt ein Molekülkristall mit isolierten
P4O6-Molekülen
vor, die formal aus P4 durch Einschub von Sauerstoffatomen in jede der
sechs Bindungen des Tetraeders aufgebaut werden kann.
Die Umgebung der P-Atome ist nahezu ideal tetraedrisch, die
P-O-Abstände liegen mit Werten von 164 pm zwischen Einfach- (P-O: 176 pm)
und Doppelbindungen (P=O : 156 pm). Der P-O-P-Winkel ist entsprechend mit 126 o
deutlich größer als der Tetraederwinkel. 





