Vorlesung Chemie der Nichtmetalle
7. Elemente der 4. Hauptgruppe (Tetrele): C, Si
7.4. Chalkogenide
|
7.4.1. CO, CO2 und Carbonate
Neben den bekannten Oxiden von Kohlenstoff, dem Monoxid CO und dem Kohlen(stoff)dioxid
CO2 kennt man die Suboxide C3O2, C4O2
und C5O2.
- CO ist ein farbloses, geruchloses,
wegen der Bildung eines CO-Komplexen mit Fe vom Hämoglobin sehr giftiges Gas.
CO ist isoelektronisch zum N2 (formal: C- und O+).
Technischen wird CO als Wassergas dargestellt:
C + H2 O ⟷ CO + H2
Diese Reaktion ist endotherm, die benötigt Energie wird praktisch durch die partielle Verbrennung
von Kohlenstoff zu u CO2 erhalten.
CO ist das Anhydrid der Ameisensäure und läßt sich durch
Entwässern mit konz. H2 SO4 daraus herstellen:
HCOOH ⟶ H2 O + CO
CO ist ein wichtiges technisches Reduktionsmittel z.B. die im Hochofen bei der Eisenherstellung
ablaufenden Reaktionen zeigen:
Fe2 O3 ⟶ Fe
Die Reduktionswirkung kann auch zum analytischer Nachweis eingesetzt werden, wenn Pd2+
zu elementarem Palladium reduziert wird:
Pd2+ ⟶ Pd (schwarz)
CO ist ein wichtiger Ligand in Metall-Komplexen (vgl. Kap. 8.3.
der Vorlesung Chemie der Metalle)
und hat als solcher sehr charakteristische Eigenschaften.
CO ist Edukt in der sogenannten Fischer-Tropsch-Synthese von Kohlenwasserstoffen:
CO + H2 ⟶ diverse Kohlenwasserstoffe
CO ist ein Luftschadstoff, die Emission lag in Deutschland bei ca. 8 106t,
wobei der Hauptanteil vom Verkehr verursacht wird. Eine wichtige Funktion von
Autokatalysatoren läßt sich damit durch die beiden folgenden Gleichungen beschreiben:
NO + CO ⟶ CO2 + 1/2 N2
CO + 1/2 O2 ⟶ CO2
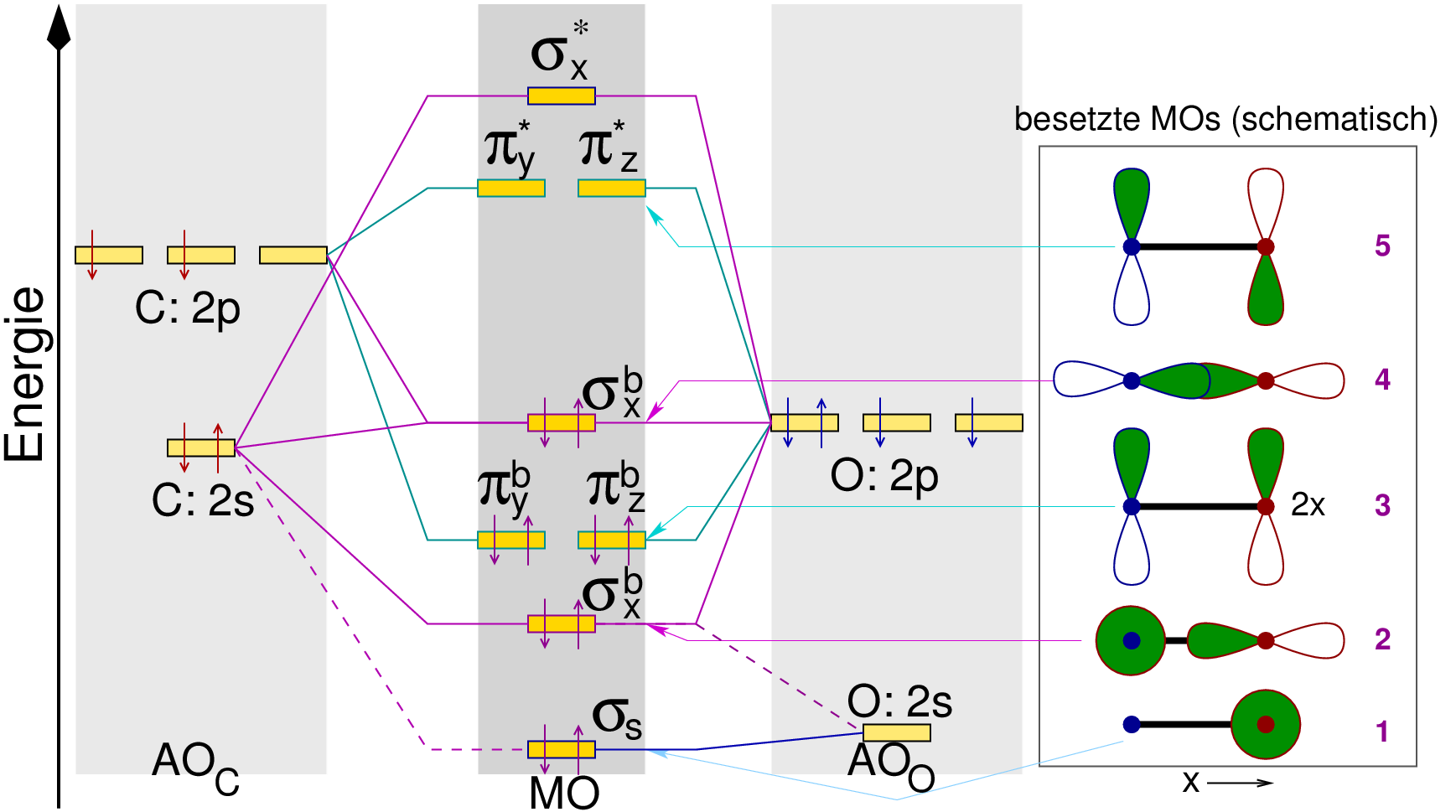 |
| Abb. 7.4.1. MO-Diagramm von
CO
‣SVG
|
Und hier gibt es noch die Formen der besetzten Orbitale zum Anschauen (als VRML-Dateien) dazu.
Es handelt sich um die Kohn-Sham-Orbitale aus einer DFT-Orca-Rechnung mit BP86-Funktional
und def2-TZVPP Basis-Funktionen (C: schwarz, O: gelb).
Die fünf besetzten Orbitale sowie eines der z.B. bei Carbonyl-Komplexen wichtigen π-antibindenden
Orbitale (das LUMO) sind nach steigender Energie geordnet, die Nummern sind in Abbildung 7.4.1.
rechts angegeben:
- Das energetisch tiefliegendste MO
weist wegen der bei Sauerstoff grossen s-p-Separation fast ausschliesslich O-s-Charakter
auf und ist nur sehr schwach bindend.
- Das zweite, ebenfalls rotationssymmetrische Molekül-Orbital
wird vor allem aus dem Sauerstoff px-Atom-Orbital
und zusätzlich auch aus den Kohlenstoff s- und px-AO gebildet
und ist damit ebenfalls schwach bindend.
- Die senkrecht zur Bindungsachse laufenden p-Orbitale von C und O kombinieren
zu einem Satz
entarteter π-bindender (und, s. bei 5, antibindender) MOs.
- Das HOMO hat
p-σ-bindenden Charakter, mit einer sehr grossen Beteiligung des
Kohlenstoff px-AOs.
- Das LUMO
bilden die beiden π-antibindenden Kombinationen
der py- und pz-AOs beider Atome.
|
- CO2 ist ebenfalls ein farbloses, geruchloses Gas,
das die Verbrennung nicht unterhält und u.a. deswegen als Löschmittel eingesetzt wird.
Festes CO2 wird Trockeneis genannt, es sublimiert bei -78oC.
Das Molekül ist linear gebaut. Das MO-Schema in Abbildung 7.4.1. zeigt, dass
zwei σ- und zwei π-Bindungen vorliegen, also ingesamt zwei Doppelbindungen.
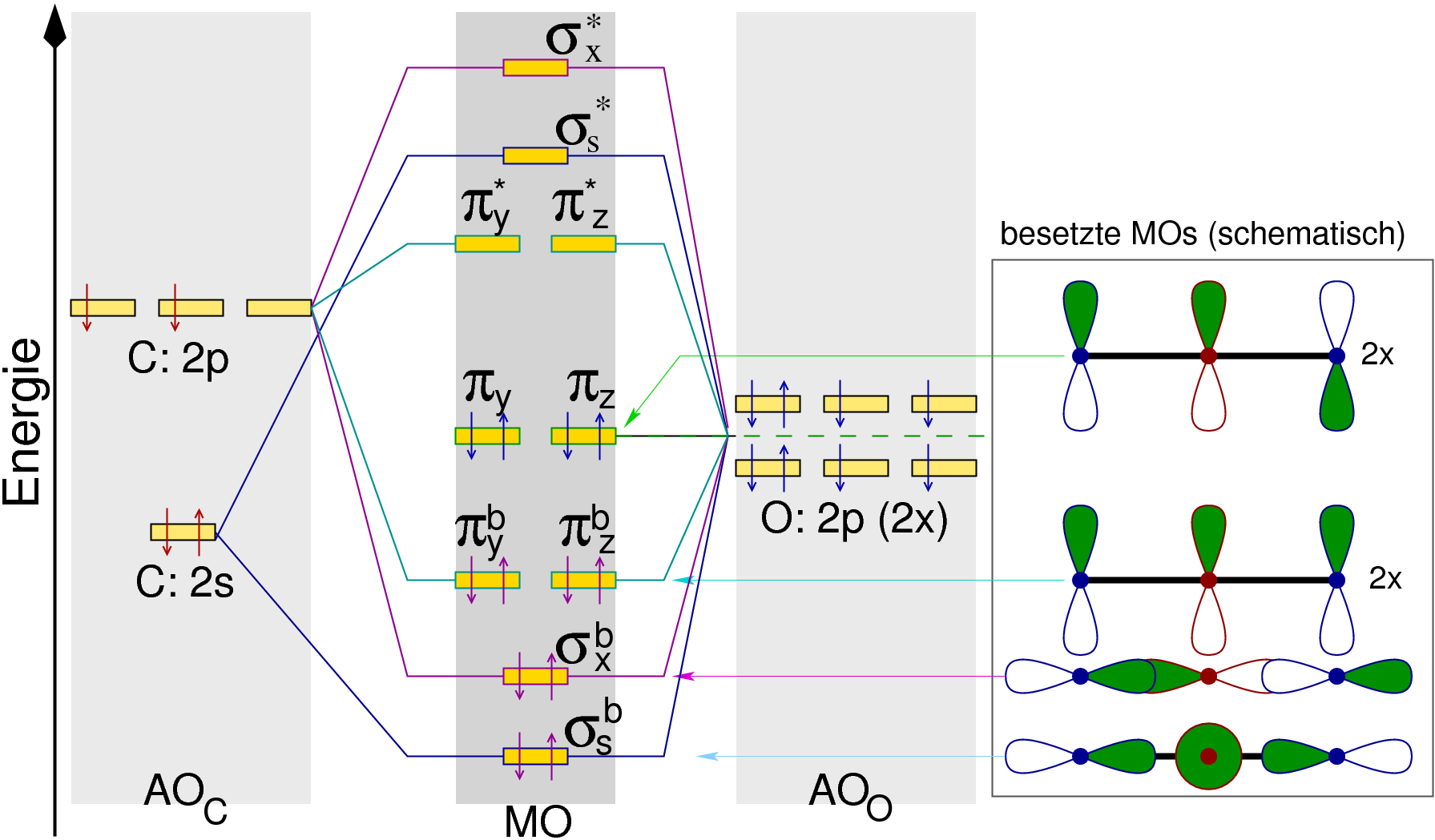 |
| Abb. 7.4.1. MO-Diagramm von
CO2
‣SVG
|
Zwischen den beiden wichtigsten Oxiden des Kohlenstoffs bestehen wichtige Gleichgewichte, die
eigene Namen tragen:
- Das Wassergasgleichgewicht:
CO2 + H2 ⟷ CO + H2 O
ist mit einer Reaktionsenthalpie von +41 kJ/mol endotherm, d.h. CO2
liegt vor allem bei niedrigeren Temperaturen vor.
- Aufgrund des Boudouard-Gleichgewichts
CO2 + C ⟷ 2 CO
das mit einer Reaktionsenthalpie von +173 kJ/mol ebenfalls endotherm ist,
tritt CO2 ebenfalls nur bei niedrigeren Temperaturen auf.
Die Atmosphäre enthält 0.035 % CO2, das als sogenanntes
Treibhausgas für den Wärmehaushalt der Erde verantwortlich ist (Treibhauseffekt).
Dadurch, daß Wärmestrahlen der Erde absorbiert werden, kommt es zur globalen Erwärmung.
CO2 ist das Anhydrid der Kohlensäure, die entsprechenden Salze sind
die Carbonate bzw. die Hydrogencarbonte. Unter der temporäre Wasserhärte
versteht man den Gehalt des Wassers an Carbonat.
- Neben diesen beiden Oxiden kennt man das Kohlenstoffsuboxid C3O2,
ein farbloses Gas, das kinetisch nur bis -78oC stabil ist.
Man erhält dieses Suboxid durch Entwässern von Malonsäure über P4O10
HOOC-CH2 -COOH ⟶ O=C=C=C=O + 2 H2 O
Es gibt mit C5O2, einem gelben sehr instabilen Festkörper, auch ein
Suboxid mit fünf C-Atomen.
7.4.2. SiO2
Im folgenden soll nur eine kurze Einführung in die Strukturprinzipien
der Silicate gegeben werden. Eine recht ausführliche Darstellung dieses
Themas findet sich in der Spezialvorlesung Silicatchemie.
Daher sind die folgenden Sachen nicht aktuallisiert.
Bereits von der einfachen chemischen Verbindung SiO2
gibt eine Reihe unterschiedlicher Modifikationen. Die wichtigsten hier als VRML-Bilder:
Genauere Erklärungen hierzu (inkl. der Phasenbeziehungen, Synthesen usw.) finden sich
in der Vorlesung Strukturchemie der Oxide im
Kap. 2.5.) .
In der Natur kommt SiO2 kristallin als α-Quarz vor. Quarz ist
Hauptbestandteil von Granit, Sandstein usw. Ausgeprägte Einkristalle nennt man
Bergkristalle, gefärbte Varietäten sind Amethyst, Citrin und Rauchquarz.
Man kennt abhängig von Druck und Temperatur insgesamt ca. 22 Phasen von SiO2,
allerdings sind nur 12 davon chemisch reines SiO2.
7.4.3. Kieselsäuren und Silicate
Silicate sind Verbindungen die formal gebildet werden, wenn
SiO2 mit verschiedenen Metalloxiden umgesetzt wird.
Da sowohl Silicium als auch Sauerstoff und die diversen Metall-Oxide in der Natur extrem
häufig sind, sind Silicate von großer Bedeutung.
Im Labor können Silicate aus SiO2 und Lauge oder auch aus Si und Lauge
erhalten werden:
Si + 2 NaOH + H2 O ⟶ Na2 SiO3 + 2 H2
Formal sind die Silicate Salze der verschiedenen Kieselsäuren, z.B. der
Orthokieselsäure (H4SiO4) oder der
Metakieselsäure (H2 SiO3).
Umgekehrt kann entsprechend zur Darstellung von Kieselsäuren die Umsetzung:
Na2 SiO3 + 2 HCl ⟶ H2 SiO3 + 2 NaCl
verwendet werden. Viele technische Produkte, die z.T. wenig definiert sind, leiten sich
von Kieselsäuren ab, z.B.
- Silicagel: vernetzte Form von Kieselsäure, enthält -Si-OH-Gruppen
- Kieselgel (SiO2 * x H2 O) = Xerogel als Trockenmittel
- Wasserglas: wässrige Lösung von Alkalisilikaten
- frisches SiO2 (Kieselsäure) geht durch Alterung in
höhermolekulare Komplexe über.
Silicate sind Hauptbestandteil der Erdkruste.
Sie enthalten neben Silicium und Sauerstoff verschiedene Metall-Kationen wie z.B.
Na+, K+, Ca2+ usw. Ihre Strukturen lassen sich
sämtlich aus über O-Ecken unterschiedlich verknüpften
SiO4-Tetraedern beschreiben. Je nach Zusammensetzung ergeben sich
dabei Bauverbände 'zwischen' den Grenzfällen:
- SiO2 (Tetraeder über alle O-Ecken verknüpft (O:Si=2)) und
- Verbindungen mit isolierten SiO4-Tetraedern (O:Si=4)
Zum Thema Silicate gibt es eine
komplette Vorlesung im Volltext auf diesem Server!
Die folgenden Abbildungen zeigen Beispiele für Silicate im
wesentlichen geordnet nach fallendem O:Si-Verhältnis (entsprechend
der Strunz-Systematik, Benennung nach Liebau)
In allen Fällen sind die SiO4-Tetraeder blau dargestellt,
die weiteren Kationen sind durch Kugeln gekennzeichnet.
In einzelnen
Strukturen sind auch die Koordinationspolyeder um die Kationen
mit eingezeichnet. Die VRML-Bilder enthalten nur die Polyeder!
Insel-(Neso)-Silicate (s. auch hier)
Die Insel- oder Neso-Silicate enthalten isolierte SiO4-Tetraeder
mit der Formalladung 4-.
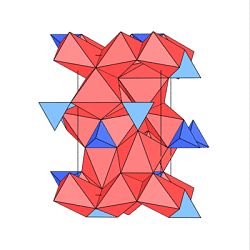 In der Gruppe der Olivine wird die negative Ladung der
Silicat-Anionen durch zwei zweiwertige Kationen/pro Si-Atom ausgeglichen; die Formel ist
demnach A2SiO4.
Olivine sind Mischkristalle aus den Phasen Mg2SiO4
(Forsterit) und Fe2SiO4 (Fayalit).
Die isolierten [SiO4]4--Tetraeder sind hier blau, die
Oktaeder um Mg rot dargestellt. In der Darstellung
einer Schicht sind die isolierten
Tetraeder und die verzweigten kantenverknüpften Ketten aus [AO6]-Oktaedern
gut zu erkennen.
Bei der Anordnung dieser Schichten zur Gesamtstruktur
bleiben die Tetraeder isoliert, die Oktaeder sind an keiner Stelle über Flächen
verknüpft, obwohl die dichten O-Schichten senkrecht zur Zeichenebene
mit der Stapelfolge ABAB angeordnet sind.
In der Gruppe der Olivine wird die negative Ladung der
Silicat-Anionen durch zwei zweiwertige Kationen/pro Si-Atom ausgeglichen; die Formel ist
demnach A2SiO4.
Olivine sind Mischkristalle aus den Phasen Mg2SiO4
(Forsterit) und Fe2SiO4 (Fayalit).
Die isolierten [SiO4]4--Tetraeder sind hier blau, die
Oktaeder um Mg rot dargestellt. In der Darstellung
einer Schicht sind die isolierten
Tetraeder und die verzweigten kantenverknüpften Ketten aus [AO6]-Oktaedern
gut zu erkennen.
Bei der Anordnung dieser Schichten zur Gesamtstruktur
bleiben die Tetraeder isoliert, die Oktaeder sind an keiner Stelle über Flächen
verknüpft, obwohl die dichten O-Schichten senkrecht zur Zeichenebene
mit der Stapelfolge ABAB angeordnet sind.
Die Gruppe der Granate basiert dagegen auf einer kubisch dichten
Kugelpackung
von Oxid-Ionen. Hier gleichen 2- und 3-wertige Kationen die Ladung
der Silicatanionen aus. Der allgemeine Formeltyp ist
A3B2[SiO]4.
Die 2-wertigen A-Kationen sind 8-fach, die 3-wertigen B-Kationen 6-fach von
Oxid-Ionen umgeben. Beispiele für Granate sind:
| Name |
Formel |
Farbe |
| Pyrop |
Mg3Al2[SiO]4 |
rotbraun |
| Almandin |
Fe3Al2[SiO]4 |
blutrot |
| Grossular |
Ca3Al2[SiO]4 |
bräunlich |
| Andradit |
Ca3Fe2[SiO]4 |
gelbgrün |
| Spessartin |
Mn3Al2[SiO]4 |
gelbrot |
| Uwarowit |
Ca3Cr2[SiO]4 |
dunkelgrün |
Gruppen-(Soro)-Silicate (s. auch hier)
Die Gruppen- oder Soro-Silicate enthalten über Ecken zu kleineren
Einheiten verknüpfte Silicat-Tetraeder.
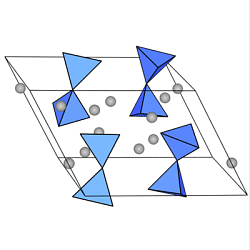 Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
 Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.
Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.
Ring-(Cyclo-)-Silicate (s. auch hier)
In den Ring- oder Cyclo-Silicaten sind [SiO4]-Tetraeder über
zwei der vier Ecken so miteinander verknüpft, daß letztlich Ringe
unterschiedlicher Größe entstehen.
Die kleinsten Ringe sind die Dreiringe [Si3O9] 6-
wie sie z.B. im Benitoit (BaTi[Si3O9])
vorliegen. Die Abbildung links zeigt die Struktur, die Ba2+-Ionen sind grau
die Ti4+-Ionen rot gezeichnet.
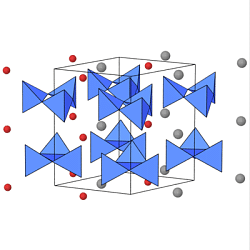

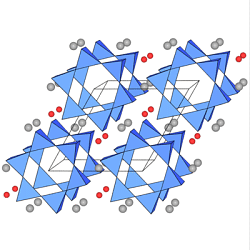 In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit).
In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit).
Die Ringe können auch zu
Doppelringen (s. auch hier) verknüpft sein. Beispiel für ein Mineral mit
4-er-Doppelringen ist der
Ekanit (ThKCaNa[Si8O24]) .
In der Abbildung unten sind die Th-Ionen grau, K schwarz und Ca/Na weiss dargestellt.

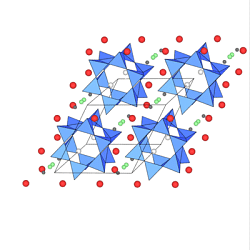 Im Milarit (KCa2AlBe2[Si12O30])
(Abb. oben rechts, K: weiss, Ca: grün, Al/Be: rot, H2O: grün)
liegen entsprechend Doppelsechsringe [Si12O30]12- vor.
Im Milarit (KCa2AlBe2[Si12O30])
(Abb. oben rechts, K: weiss, Ca: grün, Al/Be: rot, H2O: grün)
liegen entsprechend Doppelsechsringe [Si12O30]12- vor.
Ketten/Band-(Ino)-Silicate (s. auch hier)
Die Ketten- und Bandsilicate enthalten eindimensonal unendlich ausgedehnte
Silicat-Teilstrukturen. Einfachketten bestehen nur aus einer Silicattetraederkette.
Je nach Translationsperiode der Kette unterscheidet man
Einer-Einfachketten (Identität nach einem Tetraeder),
Zweier-Einfachketten (Identität nach zwei Tetraedern) und so fort. In den
Bandsilicaten sind zwei oder mehrere Einfachketten zu Bändern verknüpft.
Einfachketten
Einer-Einfachketten sind nicht bekannt.
Die Minerale mit Zweiereinfachketten
lassen sich nach der Zellmetrik zwei unterschiedlichen Gruppen zuordnen:
| Orthopyroxene |
(Laueklasse mmm) |
|
Klinopyroxene |
(Laueklasse 2/m) |
| Enstatit |
Mg2[Si2O6] |
|
Klinoenstatit |
Mg2[Si2O6] |
| Braunit |
(Mg,Fe)2[Si2O6] |
|
Diopsid |
CaMg[Si2O6] |
Unten sind als Beispiele der
Klinoenstatit Mg[SiO3] (links) und
BaSiO3 (Mitte)
dargestellt. Die Erdalkalikationen sind jeweils als graue Kugeln gezeichnet.
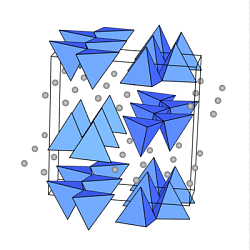

 In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
 Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.
Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.
Schicht-(Phyllo)-Silicate (s. auch hier)
Die Schichtsilicate bestehen aus Tetraederschichten (TS), die durch Kondensation
von Zweier-Einfachketten aufgebaut werden können.
Die Tetraeder einer Schicht sind dabei alle in eine Richtung ausgerichtet und
es ist stets eine Oktaederschicht (OS) ankondensiert.
Je nachdem, wie die Oktaederschicht aufgebaut ist, unterscheidet man
in tri-oktaedrische (Oktaederschichten wie z.B. Mg(OH)2)
und di-oktaedrische (Oktaederschichten wie z.B. in Al(OH)3)
Schichtsilicate.
Die weitere Unterteilung erfolgt nach der Schichtenfolge in
kationenarme Schichtsilicate (Schichtfolge TS-OS-TS) und
kationenreiche Schichtsilicate (Schichtfolge Ts-OS).
Aus diesen beiden Unterscheidungen folgen die folgenden Zusammensetzungen:
| |
|
Mg(OH)2-OS |
Al(OH)3-OS |
| TS-OS |
kationenreich |
M3(OH)4[T2O5] |
M2(OH)4[T2O5] |
| TS-OS-TL |
kationenarm |
M3(OH)2[T4O10] |
M2(OH)2[T4O10] |
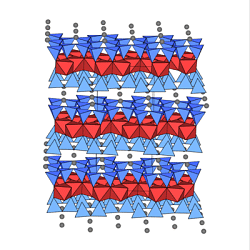
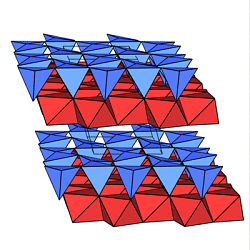
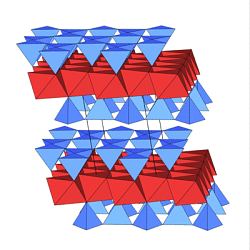
Als Beispiel sind in den untenstehenden Abbildungen
Muskovit (ganz links), Kaolin (halblinks),
Talk (halbrechts) und Serpentin (ganz rechts)
dargestellt.

Gerüst-(Tecto)-Silicate (s. auch hier)
Die SiO4-Tetraeder sind wie in den Modifikationen von
SiO2 über alle Ecken zu einem
dreidimensionalen Raumnetz verknüpft. Es handelt sich eigentlich
um Alumosilicate, in denen ein Teil des Si durch Al ersetzt ist und
die dadurch entstehende negative Gerüstladung wird durch Kationen
ausgeglichen.
Die Darstellung der Tetraeder (links) ist sehr unübersichtlich, daher
werden meist vereinfacht
nur noch die Si-Zentren dargestellt. 'Bindungen' bedeuten dann
Verknüpfungen zwischen
SiO4-Tetraedern über ein gemeinsames O-Atom (Abbildungen
rechts).
Feldspäte
VRML (Anorthit)

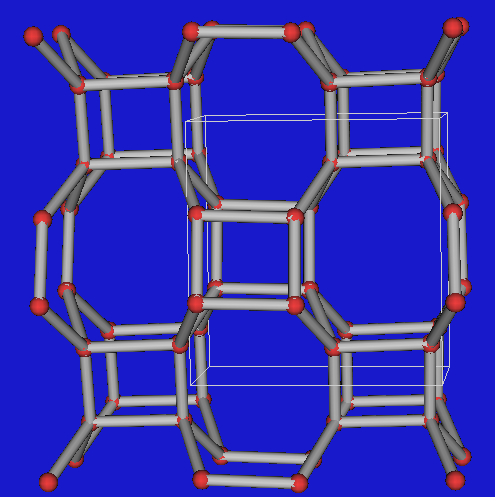
Sodalithe
Sodalith (VRML);


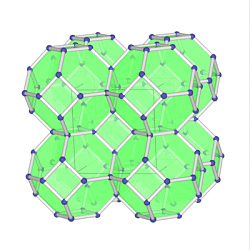 Zeolithe
Zeolithe
7.4.4. Weitere Chalkogenide
Von allen Tetrel-Elementen gibt es außer den Di- auch die Monochalkogenide, in
denen sich wieder die typische Änderungen der Koordinationszahlen
bemerkbar macht (vergl. mit AX-Salzen).
Vom Silicium kennt man das instabiles Molekül SiO, das beim Abschrecken
in eine zwar sehr luftempfindliche aber zur Herstellung von SiO2-Schutzschicht
geeignete Glas-Modifikation übergeht.
SiS bildet eine Überstruktur zum isosteren (!) schwarzen Phosphor.
SiS2 kristallisiert in einer Kettenstruktur (Fasern), in der
kantenverknüpfte Tetraeder vorliegen (vgl. BeF2).



 Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
 Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.
Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.


 In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit).
In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit). 



 In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
 Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.
Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.








 Zeolithe
Zeolithe