 |
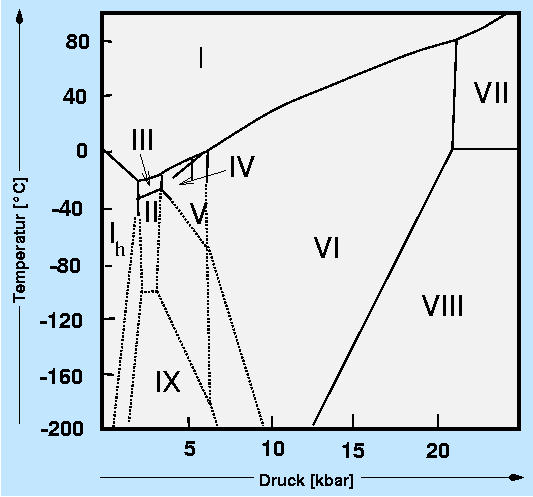
| Abb. 2.2.1. Phasendiagramm von Eis |
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |
 |
| Abb. 2.2.1. Phasendiagramm von Eis |
| Name+VRML | Struktur (gif) | Dichte | H-Ordnung | O-Ringgröße |
| Eis IC (Cristobalit-Eis) | 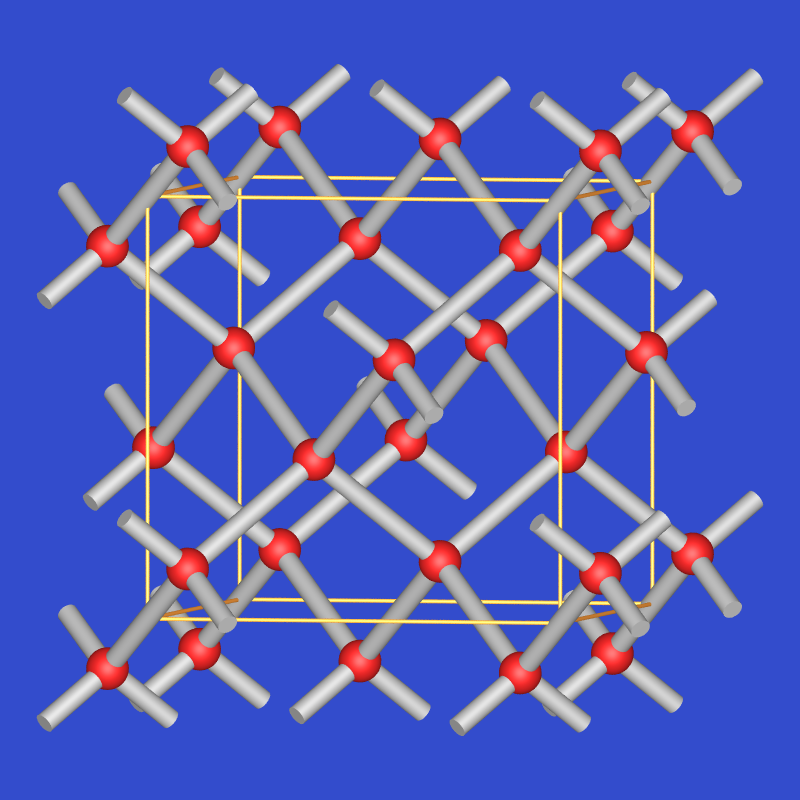 |
0.92 | nein | 6 (nur Sessel) |
| Eis IH (Tridymit-Eis) | 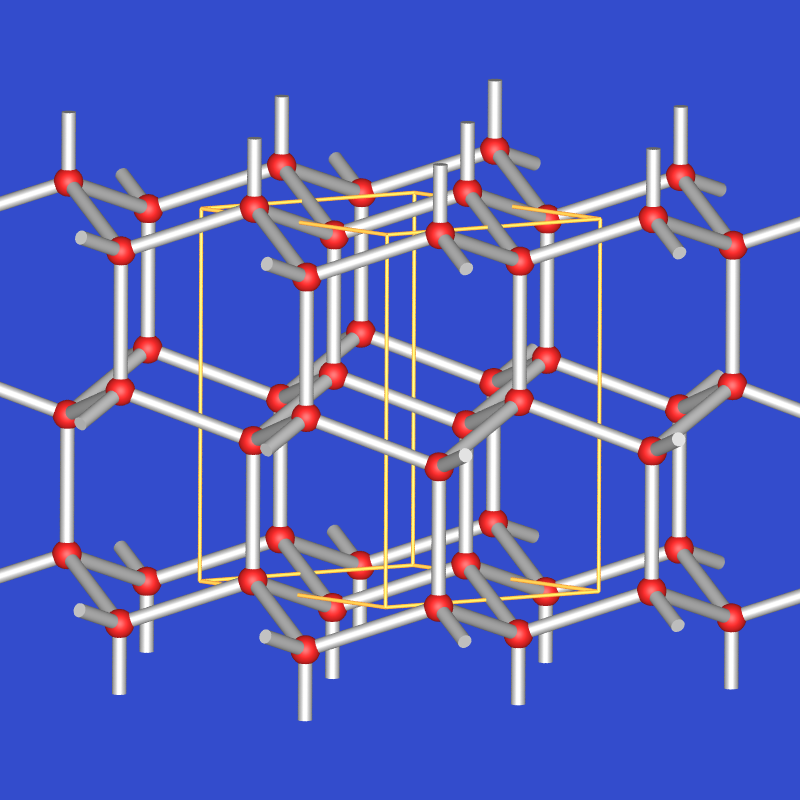 |
0.92 | nein | 6 (Wanne u. Sessel) |
| Eis II (ähnlich Tridymit, CN 4+1) | 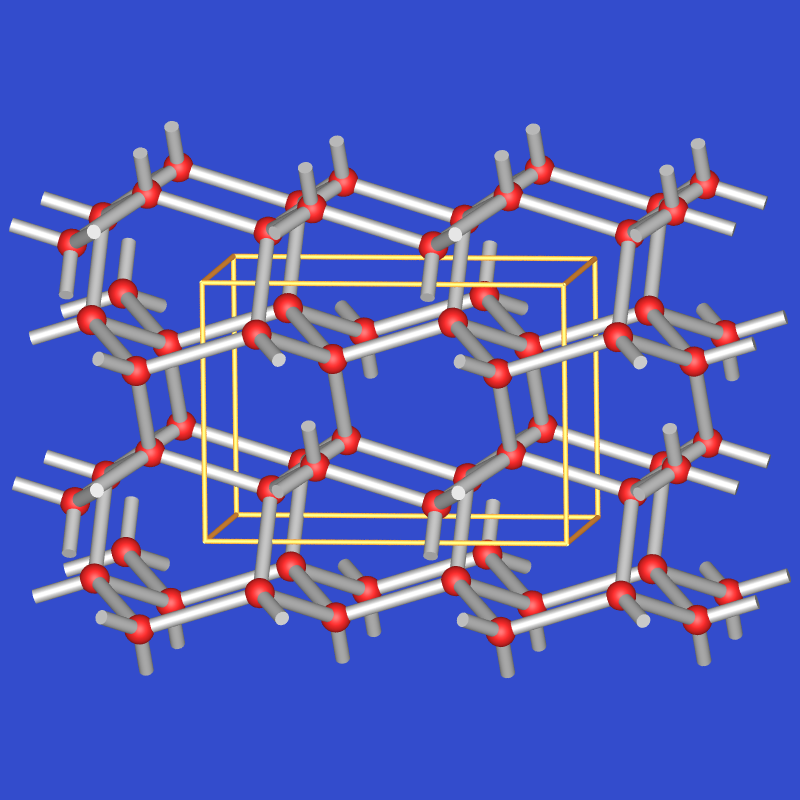 |
1.17 | ja | 6 |
| Eis III/IX (Keatit-Eis) | 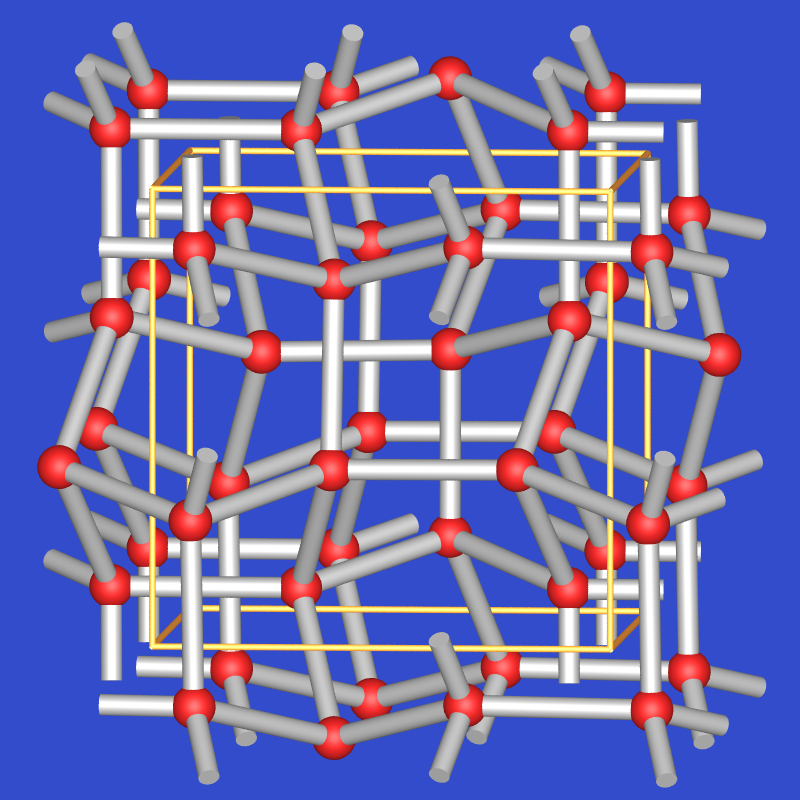 |
1.16 | nein/ja | 5,7,8 |
| Eis IV nur bei D2O | - | 1.16 | nein/ja | 5,7,8 |
| Eis V (stark verzerrte Tetraeder) | 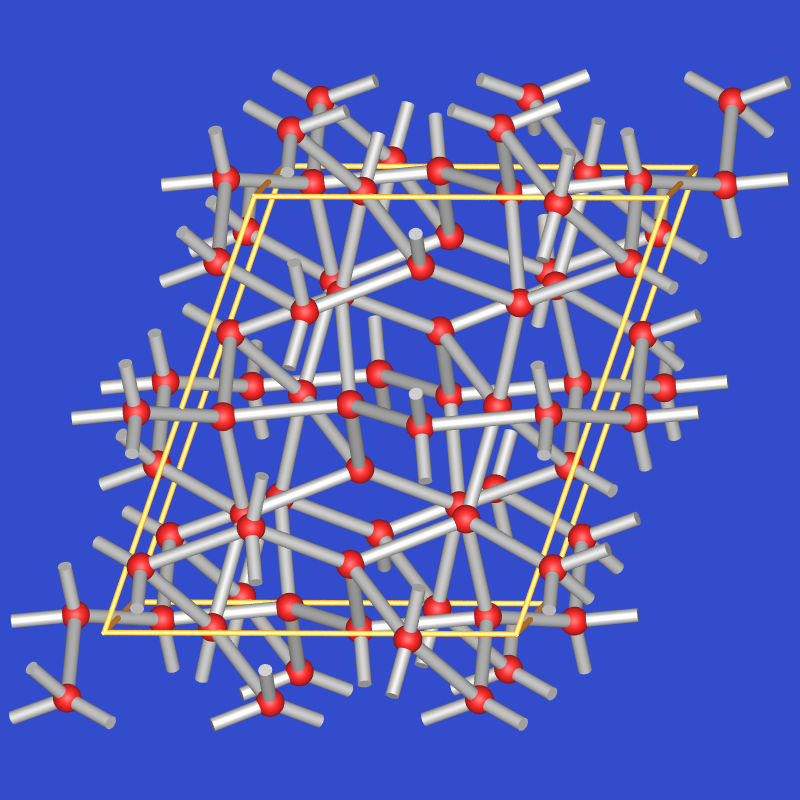 |
1.23 | nein | 4,5,6,7 |
| Eis VI (2x Edingtonit) | 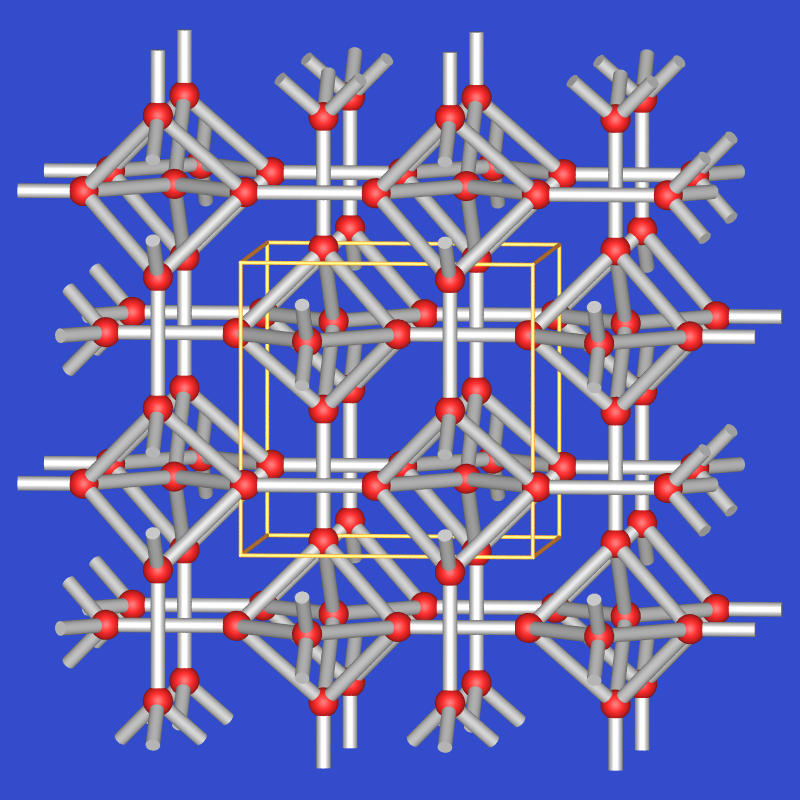 |
1.31 | nein | 8 |
| Eis VII/VIII (2x Cristobalit) |  |
1.31 | nein/ja | 6 (2x!) Sessel |
Die beiden wichtigsten Modifikationen im Detail:
Bei Normaldruck entsteht aus Wasser durch Abkühlen Tridymit-Eis (Eis-Ih oder gewöhnliches oder hexagonales Eis, s. Abb. 2.2.2.). Die O-Atome besetzen die Si-Positionen im Tridymit (SiO2) oder die Zn- und S-Positionen im Wurtzit (hexagonaler Diamant). Das nebenstehende Bild zeigt nur die Sauerstoffpositionen (rote Kugeln), die vollständig der Struktur des hexagonalen Diamants entsprechen. Die O-Atome sind nahezu tetraedrisch von 4 weiteren O koordiniert (da hier annähernd das für hexagonal dichte Packungen ideale c/a Verhältnis vorliegt). Es werden damit Sauerstoff-6-Ringe gebildet, die senkrecht [001] Sessel- und in [001] Wannen-Konformation aufweisen. Die O-O-Abstände betragen 275 pm, die H-Atome sind fehlgeordnet. IR bzw. RAMAN-Spektren zeigen jedoch, daß jedes-Atom zu einem O gehört und ein näheres H (97 pm = Bindung), und ein weiteres H-Atom (178 pm = H-Brücke) existiert. Der H-O-H-Winkel beträgt 105o, die Wasserstoffatome befinden sich annähernd auf der Verbindungslinie (graue Bindungsstäbe) der entsprechenden O-Partner.
 |
 |
| 2.2.2. Struktur von Tridymit-Eis | 2.2.3. Struktur von Cristobalit-Eis |
Eis Ic (kubisches, Cristobalit-Eis, s. Abb. 2.2.3.) läßt sich aus dem Gas im Vakuum bei -120 bis -140 oC abscheiden und ist oberhalb 153 K metastabil gegen den Zerfall in Ih. Die Dichte entspricht der von Ih, die H-Atome sind wie bei Ih ungeordnet. Die O-Atome besetzen die C-Positionen im Diamant (s. Abbildung), so daß hier wie im Tridymit-Eis ebenfalls Sechsringe auftreten, die jedoch alle in Sesselkonformation vorliegen.
Neben diesen beiden Normaldruckphasen existiert eine große Zahl von Hochdruckphasen, deren römische Nummerierung und Benennung relativ unsystematisch erfolgt (s. obige Tabelle). In den Druckmodifikationen werden die Tetraeder deformiert, es werden dichtere Strukturen mit kleiner Ringen gebildet. Die Änderungen in den Bindungslängen sind dagegen nur gering.
 Die Darstellung erfolgt technisch durch Autoxidation von 2-Alkylanthrachinon.
H2O2 wird als Bleichmittel für Textilien, Papier, Leder, Haare
verwendet und ist ein wichtiger Grundstoff der chemischen Industrie.
Unterhalb von -0.4 oC kristallisiert H2O2.
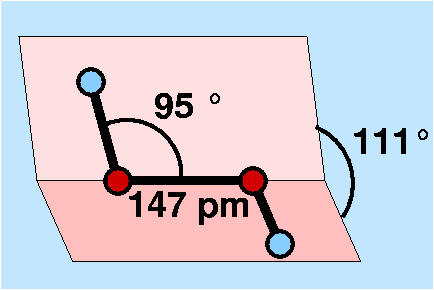
Im Kristall liegen die Moleküle in gauche-Konformation vor,
die Geometrie des Moleküls (nebenstehend die Gasphasenwerte)
wird stark durch die Ausbildung von
H-Brücken beeinflußt.
H2O2 ist das kleinstes Molekül mit gehinderter
Rotation um eine Einfachbindung.
Während der Diederwinkel im Gas: 111o ist, liegt er in festem H2O2
( hier ein VRML-Bild der Neutronenstruktur)
bei 90 o.
Daneben gibt es kristalline Phasen, in denen die Diederwinkel von 90o bis 180o
variieren: Z.B. liegt in in Li2C2O4. H2O2 mit einem Diedederwinkel
von 180o eine planare trans-Konformation vor.
Die Darstellung erfolgt technisch durch Autoxidation von 2-Alkylanthrachinon.
H2O2 wird als Bleichmittel für Textilien, Papier, Leder, Haare
verwendet und ist ein wichtiger Grundstoff der chemischen Industrie.
Unterhalb von -0.4 oC kristallisiert H2O2.
Im Kristall liegen die Moleküle in gauche-Konformation vor,
die Geometrie des Moleküls (nebenstehend die Gasphasenwerte)
wird stark durch die Ausbildung von
H-Brücken beeinflußt.
H2O2 ist das kleinstes Molekül mit gehinderter
Rotation um eine Einfachbindung.
Während der Diederwinkel im Gas: 111o ist, liegt er in festem H2O2
( hier ein VRML-Bild der Neutronenstruktur)
bei 90 o.
Daneben gibt es kristalline Phasen, in denen die Diederwinkel von 90o bis 180o
variieren: Z.B. liegt in in Li2C2O4. H2O2 mit einem Diedederwinkel
von 180o eine planare trans-Konformation vor.
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |