
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |
 |
 |
| 2.3.1. Struktur von α-BeO | 2.3.2. Struktur von ß-BeO |
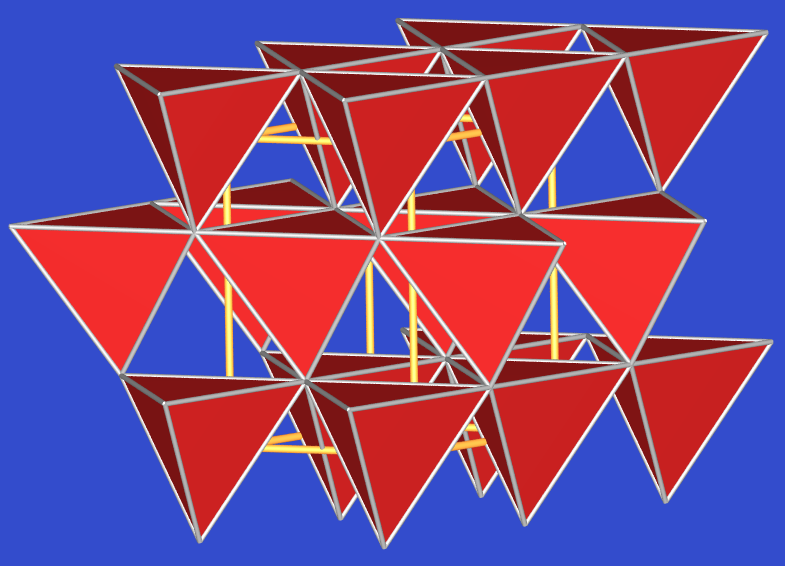
Oberhalb von 2050 bis 2100 oC geht es in die ß-Form (Abb. 2.3.2) über, die sich nicht abschrecken läßt. Die Struktur dieser Hochtemperaturmodifikation enthält BeO4-Doppeltetraeder (zwei über eine Kante verknüpfte Tetraeder). Dadurch resultieren kurze Be-Be-Abstände von 224 pm, die den Abständen im metallischen Element entsprechen. Isotyp dazu ist γ-LiAlO2.
Die Sauerstoffpackung ist damit in beiden Modifikationen gleich, die Be-Atome besetzen jeweils in unterschiedlicher Anordnung die Hälfte der Tetraederlücken in einer hexagonal dichten Packung.
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |