| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |
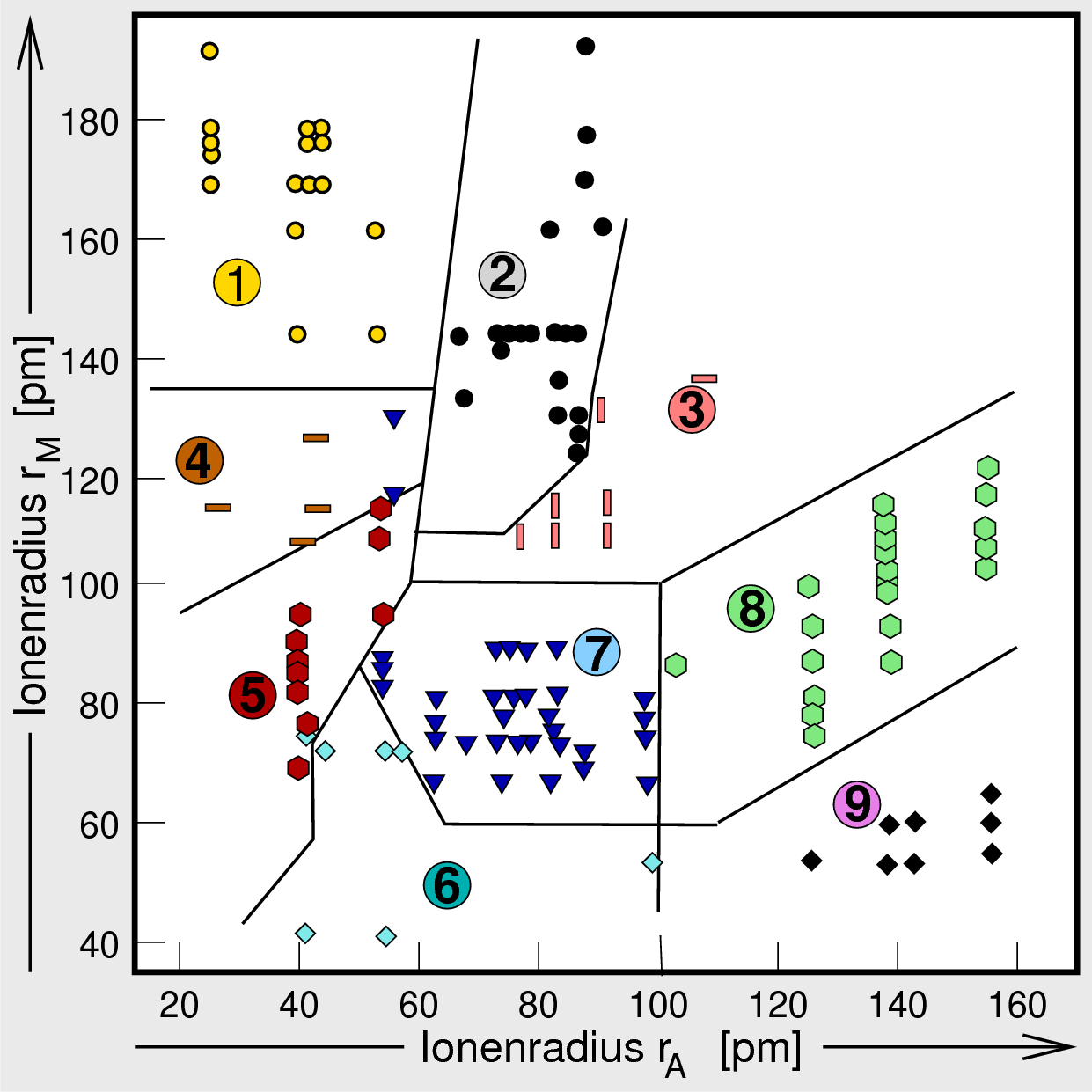
Das Strukturfeld in Abbildung 5.1. zeigt die verschiedenen Vertreter der neun grundlegenden Strukturtypen in Abhängigkeit von den Ionenradien von A und B. Isotype Verbindungen befinden sich jeweils in bestimmten Bereichen (Feldern) des Diagramms (daher die Bezeichnung 'Strukturfelddiagramm').
Erläuterungen:

| 5.1. Strukturfeld der Oxide der allgemeinen Zusammensetzung AB2O4 ‣SVG |
Betrachtet man zunächst nur die Koordinationszahlen der Kationen A und B (ohne die Strukturtypen genauer zu differenzieren), so lassen sich drei Gruppen von Strukturtypen unterscheiden (Die Koordinationszahlen sind als hochgestellte römische Zahlen angegeben):
|
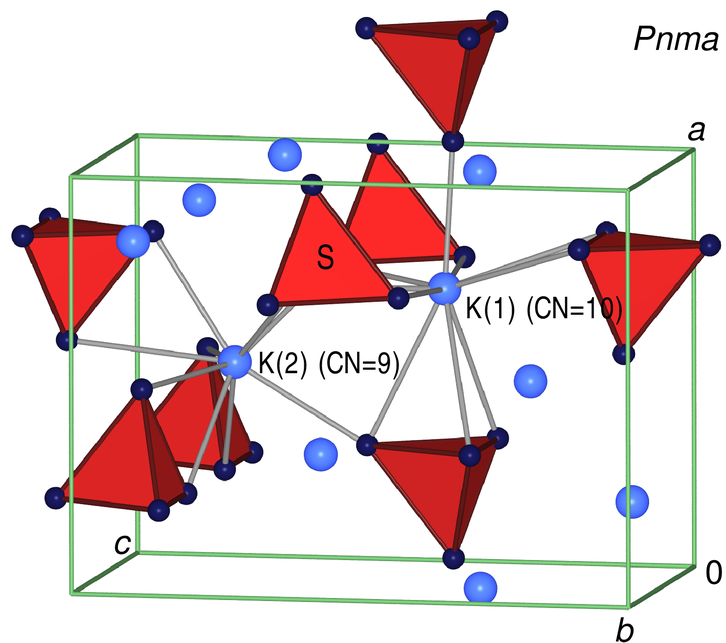
Der orthorhombische β-K2SO4-Typ
(entsprechend B2AO4)
wird bei kleinem Ionen A und sehr großen Ionen B ausgebildet.
Entsprechend der Formel
KXKIXSIVO3VIOV
sind die großen B-Kationen von 9 bzw. 10 O-Nachbarn umgeben. A ist
tetraedrisch koordiniert. Für die Oxid-Ionen ergeben sich
Koordinationszahlen von 4 und 5. Der β-K2SO4-Typ ist ein sehr weit verbreiteter Strukturtyp. Die Struktur enthält isolierte [SO4]2--Tetraeder und zwei kristallographisch verschiedene K-Positionen mit CN 9 bzw. CN 10 gegen Sauerstoff. Die Struktur wird bei Oxiden verschiedener Typen beobachtet:
Er ist auch bei Sulfiden, Seleniden und Halogeniden häufig. Die [AO4]-Tetraeder sind nahezu unverzerrt. Ausnahmen sind z.B. Cs2CuBr4, wo die [CuO4]-Tetraeder Jahn-Teller-verzerrt sind (Tetraederwinkel: 100-130 o). Verwandt mit dem β-K2SO4-Typ ist der Na2SO4-I -Typ, der von Na2SO4 oberhalb von 241 oC eingenommen wird. Hier sind die [SO4]-Tetraeder Rotations-fehlgeordnet. Dieser Typ ist bei Hochtemperaturphasen recht häufig. Die Vertreter dieser Strukturtypen verfügen z.T. über große Lösungsbereiche, z.B. sind Ag2SO4 und Rb2SO4 lückenlos miteinander mischbar. Weitere ähnliche Strukturen sind Sr2CrO4, α-Ca2SiO4 und Na2CrO4. |
|
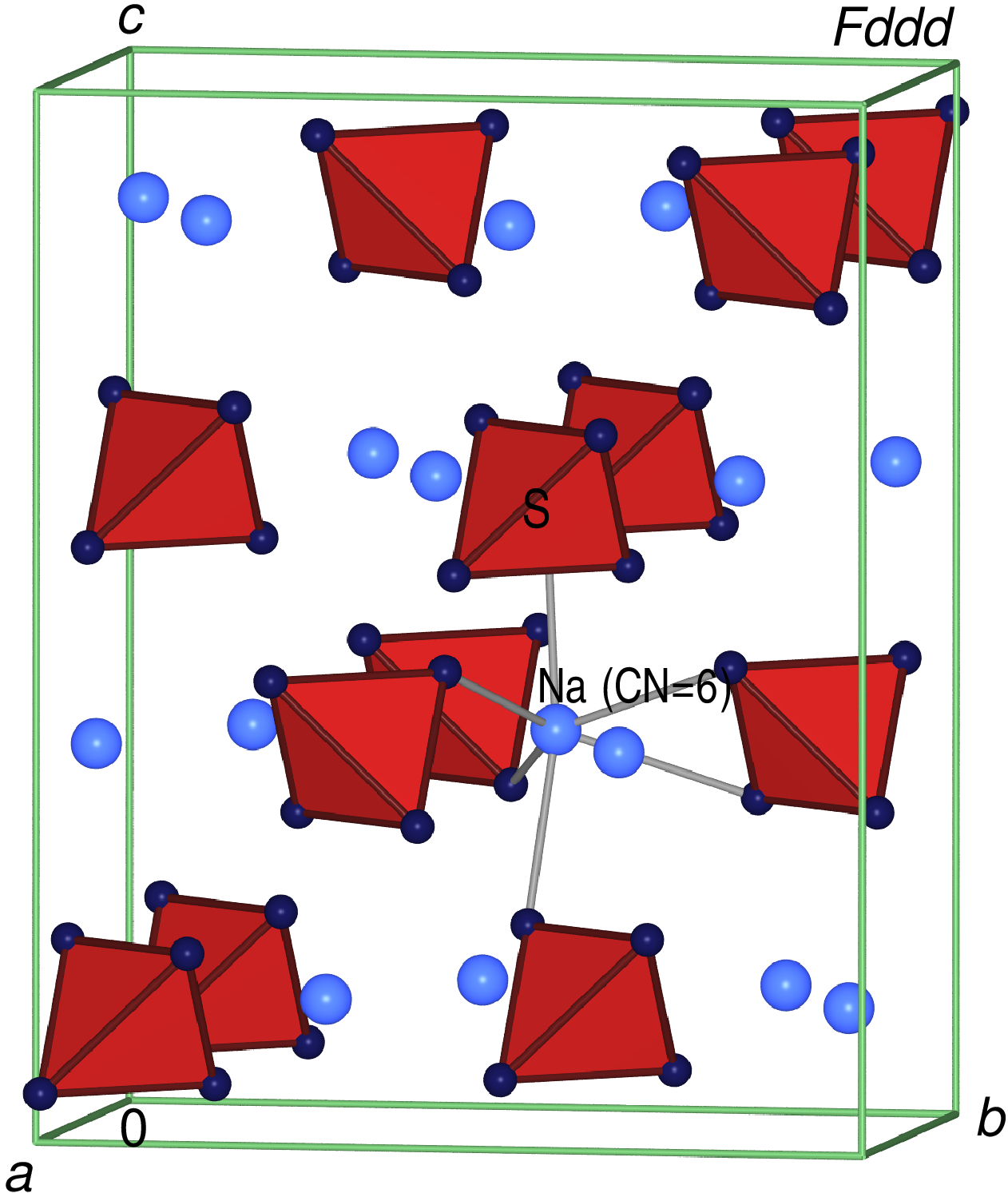
Die Thenardit-Struktur
(Raumtemperaturform von Na2SO4)
liegt bei etwas kleinerem B (kleiner 130 pm) vor. Die Koordinationszahl von B ist hier
zwar 6, jedoch ist sie nicht oktaedrisch.
Zwischen isolierten [SO4]2--Tetraedern
sind die Natriumionen in verzerrt trigonal-prismatischer Umgebung eingelagert. Beispiele für diesen Strukturtyp sind, neben der Raumtemperaturform von Na2SO4, Na2SeO4, Ag2SO4 und Cd2SiO4.
|
|
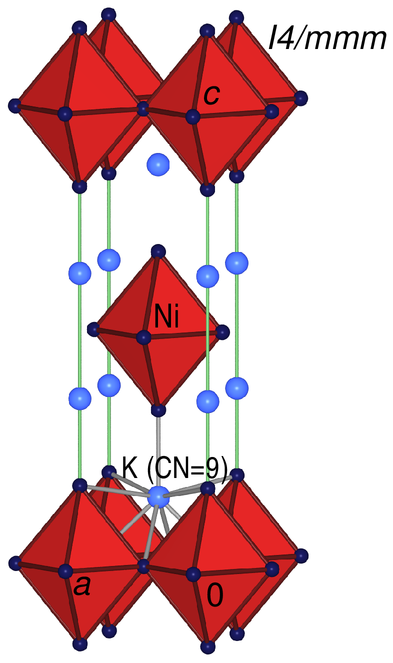
Der K2NiF4-Typ
liegt bei größeren Ionenradien von A (> 60 pm, im Bereich der Oktaederkoordination für A)
und bei recht großen (> 120 pm) Radien von B.
Die Struktur besteht aus [AO6]-Oktaedern, die über
vier Ecken zu Schichten [AO4/2O2] (nach Niggli) verknüpft sind.
Die zwischen die Schichten eingelagerten B-Ionen weisen eine Koordinationszahl von 9
gegen Sauerstoff auf.
Der K2NiF4-Typ kann auch als 'Intergrowth' von Perowskit-
und NaCl-Typ beschrieben werden.
Entsprechend sind Verbindungen mit anderen Stapelfolgen
bekannt:
Der Strukturtyp ist (vor allem bei den Halogeniden) weit verbreitet, wird aber auch bei vielen Oxiden beobachtet:
Abgeleitete Varianten sind:
|
|
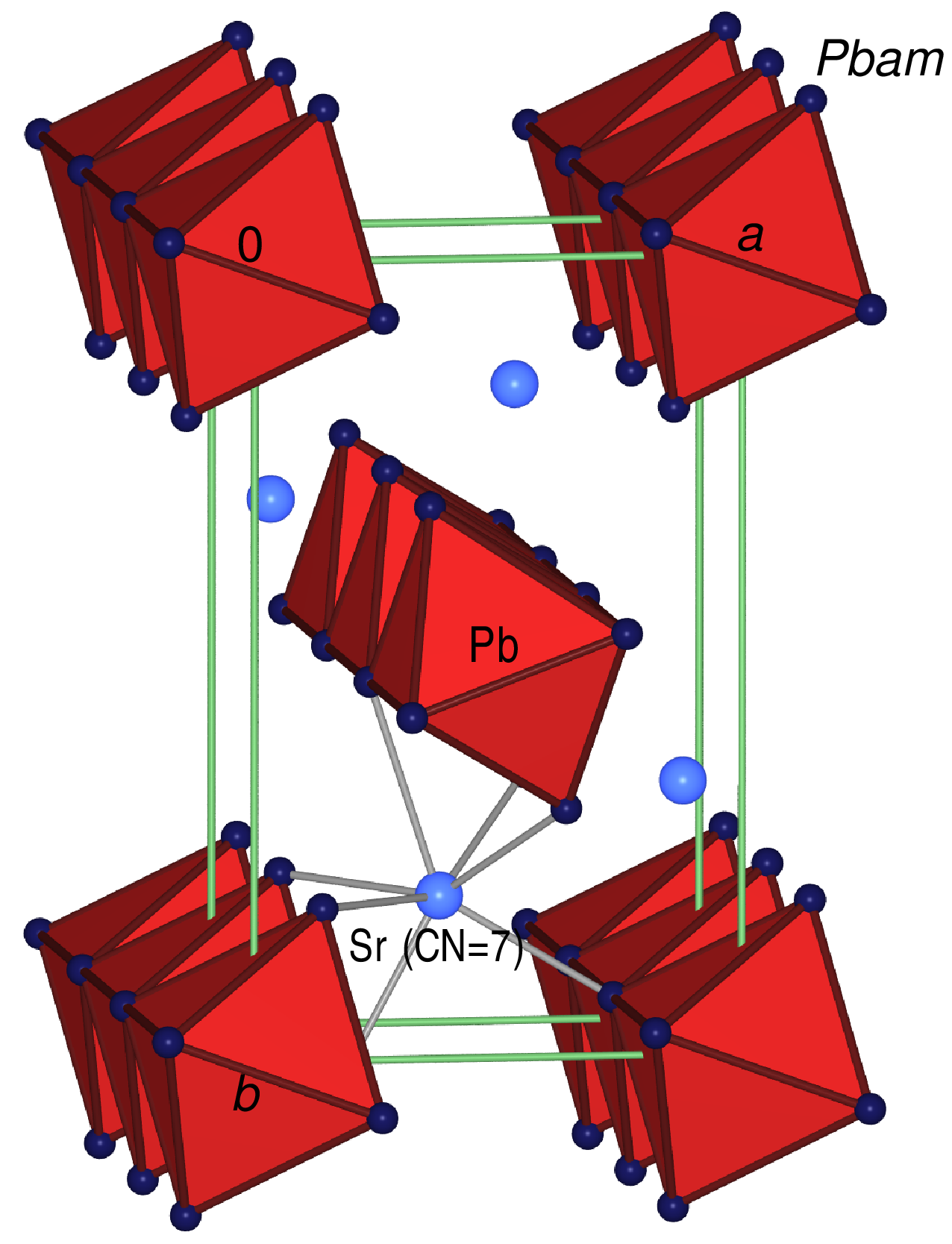
Bei größeren A- und B-Kationen tritt der
Sr2PbO4-Typ
auf (mit Angaben der Koordinationszahlen: Sr2VIIPbVIOV4).
Die Struktur besteht aus [PbO6]-Oktaedern, die über gemeinsame Kanten zu Strängen
verbunden sind (nach Niggli: [PbO2O4/2]) und zwischen denen sich die Sr2+-Ionen (CN=7) befinden.
Beispiele für diesen Strukturtyp sind (Ca,Sr,Cd)2(Pb,Sn)O4 und
Cd2PtO4.
Sehr ähnlich ist die Struktur von Ca2IrO4, in der aber drei verschiedene
Koordinationszahlen für B vorliegen.
|
|
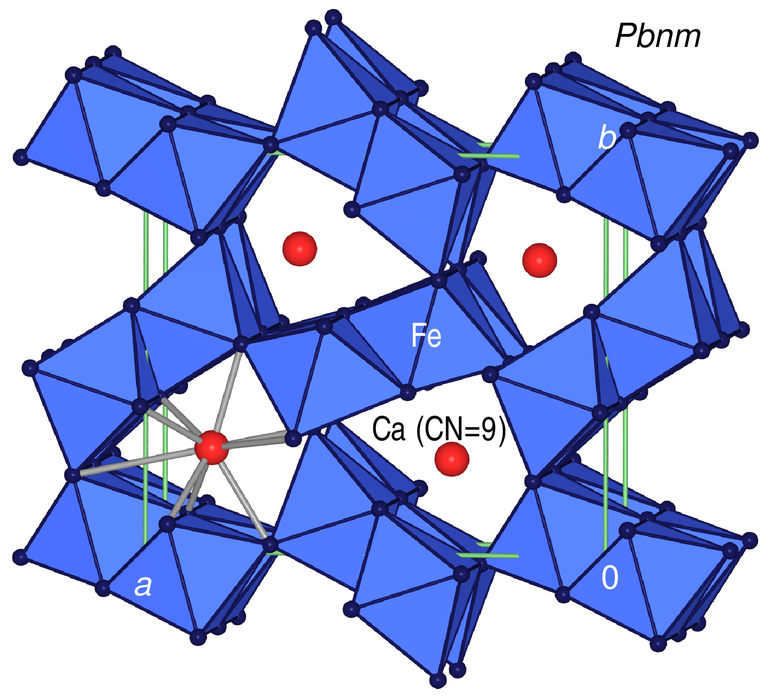
Der CaFe2O4-Typ
mit Koordinationszahlen von 6 und 8 (CaIXFe2VIO4V)
tritt dann auf, wenn
A groß und B von mittlerer Größe ist.
Die Struktur besteht aus [FeO6]-Oktaedern, die über Ecken und Kanten
zu einem dreidimensionalen Netzwerk verknüpft sind, wobei Doppelstränge aus Oktaedern
vorliegen. (Diese Doppelstränge verlaufen in obiger Abbildung aus der Tafelebene heraus).
Jedes Oxid-Ion ist an drei Oktaedern beteiligt, nach Niggli also [FeO6/3].
In den Kanälen sind die Ca-Ionen (CN=9) eingelagert.
Der CaFe2O4-Typ
kommt vor allem bei Verbindungen A2+B23+O4
(z.B. SrY2O4) aber auch bei Verbindungen
A1+B3+B4+O4 (z.B. NaAlGeO4) vor.
Neben den Beispielen, in denen B die oktaedrische Koordination einnimmt,
gibt es mit
MgSc2O4
auch ein Beispiel mit invertierter Verteilung
(Mg- und die Hälfte der Sc-Atome in Oktaederkoordination,
die andere Hälfte der Sc auf den Ca(=A)-Position).
|
|
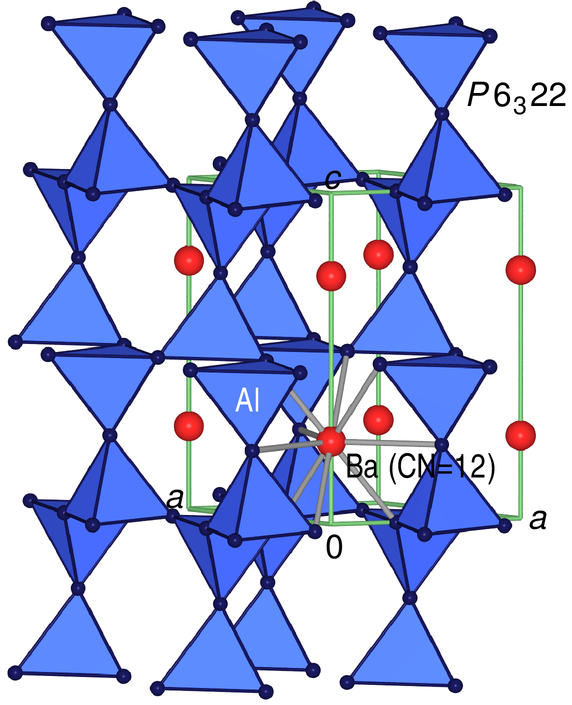
Der hexagonale BaAl2O4-Typ
liegt vor, wenn A sehr groß (>120 pm) und B sehr klein (< 60 pm)
ist. Die Struktur besteht aus [BO4/2]-Tetraedern, die über alle Ecken
verknüpft sind. Die B-Kationen befinden sich in den
Hohlräumen und sind von 12 Oxid-Ionen koordiniert (gestopfter Tridymit). Beispiele für Verbindungen dieses Typs sind
|
|
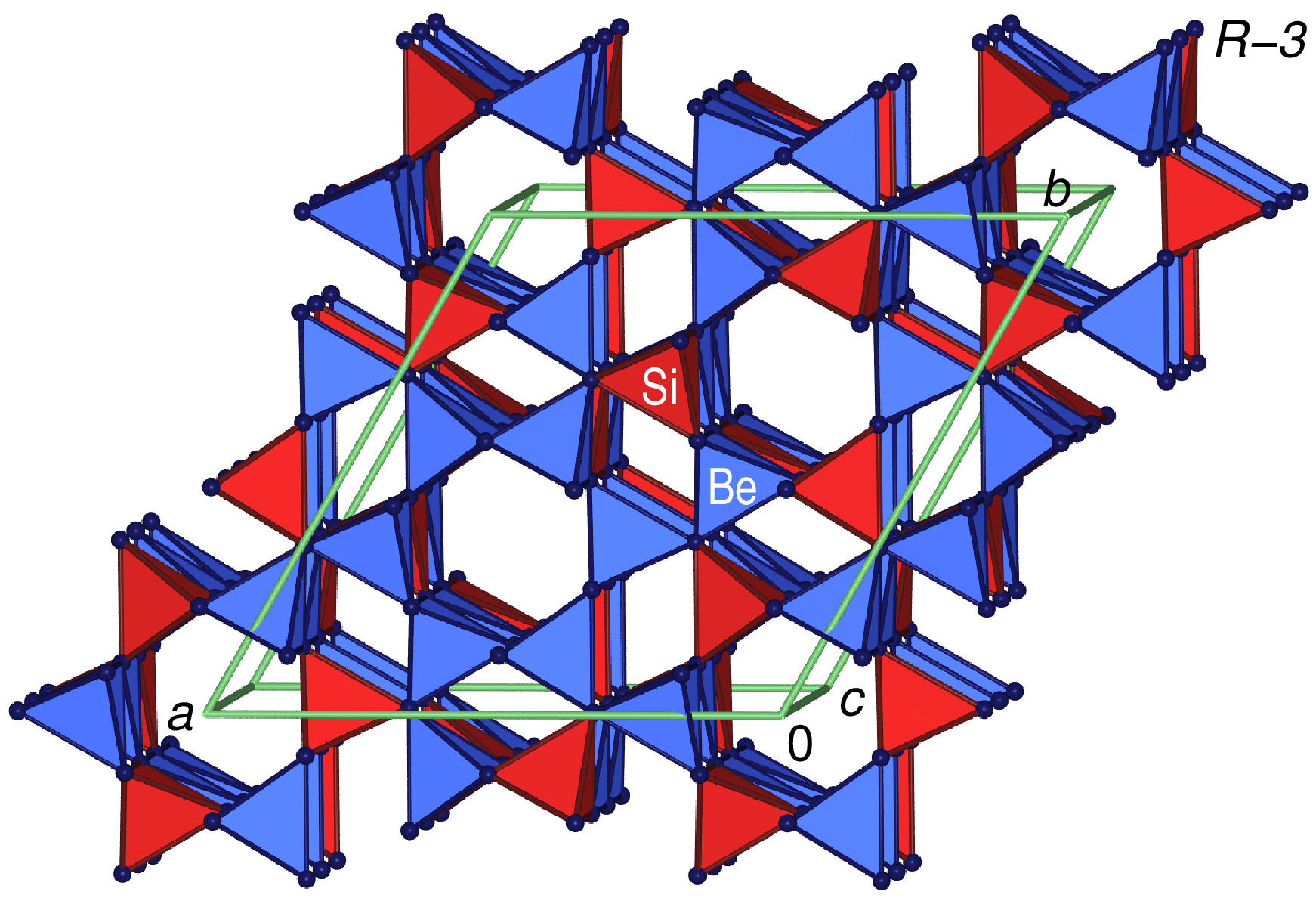
Wenn die Ionen A und B beide sehr klein sind, kommen sie beide nur in tetraedrischer Koordination
gegen Oxid-Ionen vor (Be2SiO4, Phenakit).
Damit ergibt sich als Formel Be2IVSiIVO4.
Die Struktur läßt sich als drei-dimensionales Netzwerk aus [(Be,Si)O4]-Tetraedern
beschreiben. Jede O-Polyederecke gehört zu drei Tetraedern, von denen jeweils
eines ein [SiO4]-Tetraeder ist (nach Niggli: [(Be/Si)O4/3])
Es resultiert eine Gerüststruktur, die deutlich weniger offen ist als die der SiO2-Modifikationen.
Es bleiben jedoch Kanäle [001] um die c-Achse der rhomboedrischen Struktur. Beispiele für diesen Strukturtyp sind Li2WO4, Al23+Cd2+O4 und LiAlGeO4.
|
|
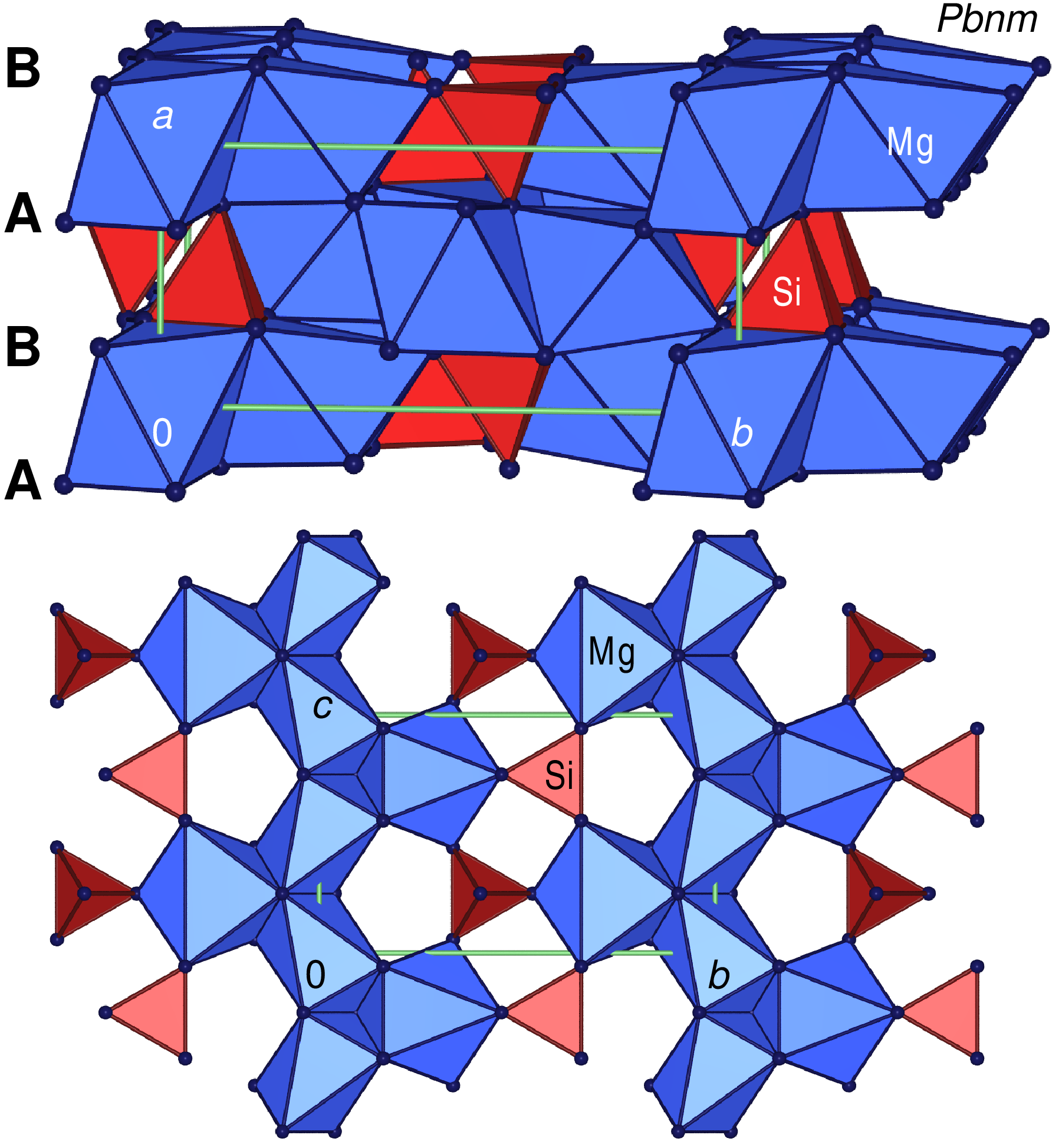
Olivin
(Gesamtstruktur und
eine einzelne Schicht)
ist der allgemeine Name für die Verbindungen der Mischungsreihe
Mg2SiO4 (Forsterit) - Fe2SiO4
(Fayalit). Mit Kennzeichnung der Koordinationszahlen gilt:
Fe2VISiIVO4IV.
Die Struktur besteht aus einer hexagonal dichten Packung (h.c.p.) von
O2--Ionen, in denen die A-Kationen (Si) die Tetraederlücken und
die B-Kationen (Fe) die Oktaederlücken besetzen.
Die dichten Schichten (Stapelfolge |:AB:|) verlaufen senkrecht [100] in der orthorhombischen
Elementarzelle (Aufsicht s. unten links). Die Oktaeder sind über Kanten zu Stränge (mit weiteren ankondensierten
Oktaedern) verknüpft. Die Schichten sind um 1/2 in b versetzt so übereinander
angeordnet, dass sich keine gemeinsamen Flächen zwischen den Oktaedern
ergeben. Die zwei kristallographisch verschiedenen B-Positionen sind
im Olivin durch Mg2+ und Fe2+ z.T. statistisch besetzt, z.T. auch ausgeordnet.
Die Struktur wird bei Oxiden verschiedener allgemeiner Typen beobachtet:
|
|
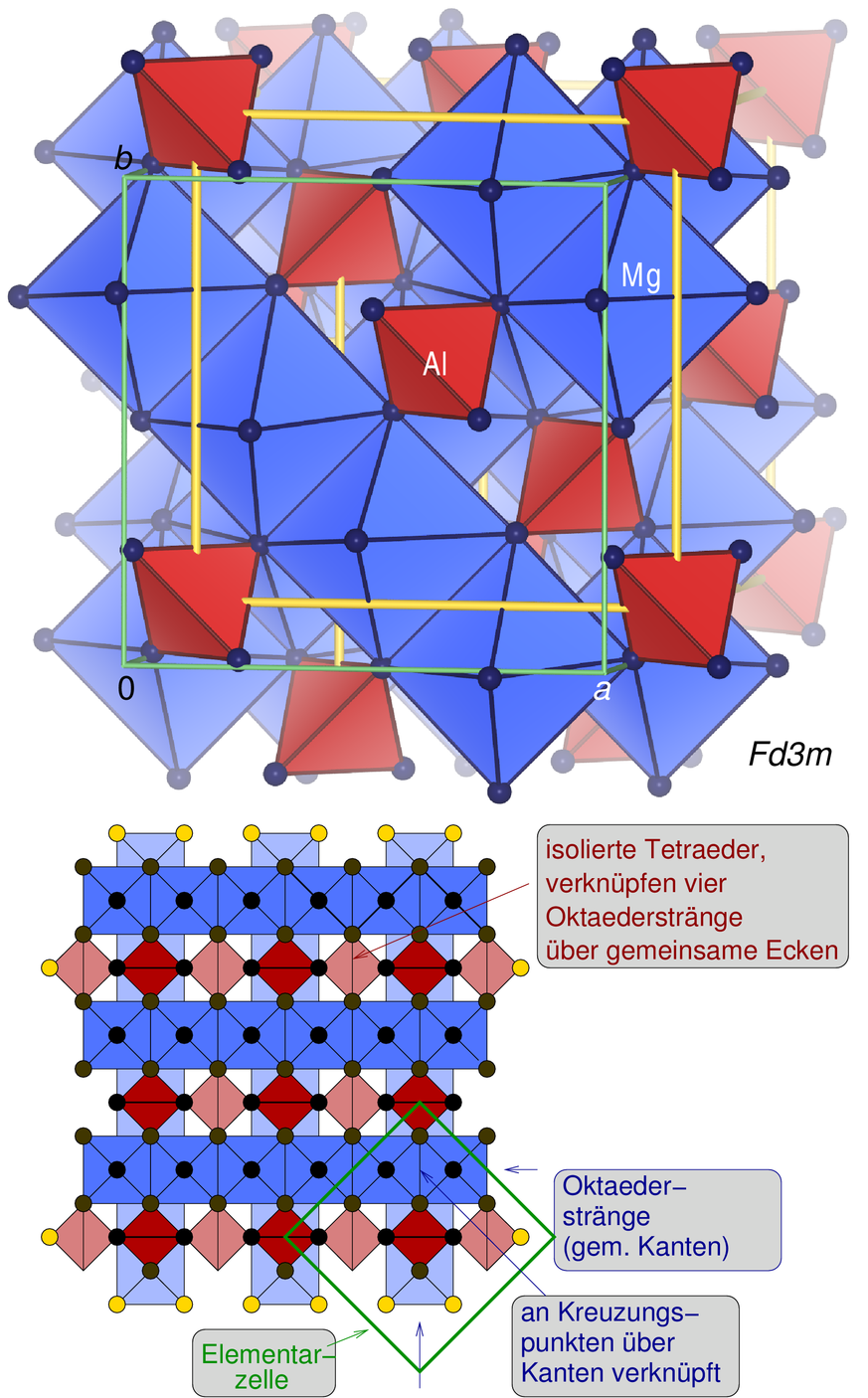
Die Kristallstruktur des Spinells
läßt sich analog der des Olivins beschreiben, nur dass eine
f.c.c.-Packung der O2- vorliegt (Stapelfolge |:ABC:|); auch hier sind
die Hälfte der Oktaeder- und ein Achtel der Tetraederlücken besetzt.
Der Spinelltyp ist der häufigste Strukturtyp
der Verbindungen AB2O4.
Die Koordinationsoktaeder um B sind über zwei Kanten zu Strängen
verknüpft, die kreuzweise übereinander liegen.
In diesem Netzwerk befinden sich die [MgO4]-Tetraeder, die voneinander
isoliert sind und mit je drei Oktaedern verknüpft sind.
Wie beim Olivin liegen auch hier keine gemeinsamen Flächen zwischen den Polyedern vor. Weitere Abbildungen zur Spinell-Struktur s. Kap. 4.4. der Vorlesung Chemie der Metalle. Die Struktur wird bei Oxiden verschiedener Typen beobachtet:
Nach dem Besetzungsverhältnis lassen sich weiter unterscheiden:
Als Faustregel läßt sich feststellen, dass die meisten Spinelle zur Gruppe der (2,3)-Normalspinelle gehören. Sie zeigen eine größere Madelungkonstante, es kommt zu einer besseren Abschirmung der hochgeladenen Ionen. (4,2)-Spinelle mit einem u-Parameter größer 0.380 sind fast ausnahmslos Inversspinelle. Voraussagen über die Kationenverteilung sind im Einzelfall oft nicht trivial.
|
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |