
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |
| gas | flüssig | 1 | 2 | 3 | ||||
| SO3 (gas) | -> 44oC -> | SO3 (fl.) | -> 17oC -> | gamma-SO3 | H2O Spuren | ß-SO3 | nur direkt aus dem Gas, -80oC | alpha-SO3 |
| trig. planare SO3 Moleküle, | eisartig | asbestartig | Schicht, Mp: 62 oC | |||||
| im Gleichgewicht mit cyclischen Trimeren S3O9/ |  |
 |
Ketten wie in der ß-Form, aber | |||||
| D3h | orthorhombisch | monoklin | zu Schichten verknüpft | |||||
| S-O: 143 pm | S-O: 162 pm (im Ring); 137-143 pm (exo-O) | S-O: 162 pm (in der Kette); 141 pm (exo-O) | thermodynamisch stabil |
Im Handel ist sowohl festes SO3, eine Mischung der ß- und der alpha Form (MP: -40 oC) als auch die flüssige Form, die nur durch Zusatz von Borsäure usw. stabilisiert ist.
 |
 |
 |
| 2.7.1. Struktur von SeO2 (Selenolit) | 2.7.2. Struktur von SeO3 | 2.7.3. Struktur von Se2O5 |
SeO2 (Selenolit, s. Abb. 2.7.1.) enthält SeIV, ist also das Anhydrid der selenigen Säure. Es bildet weiße Kristalle, die bei 340 oC schmelzen. Es kann entweder durch Entwässern von H2SeO3 oder auch direkt aus den Elementen dargestellt werden. Die Struktur weist unendliche Ketten flacher SeO3-Pyramiden auf (Se-O in der Kette: 178 pm, exo-Se-O: 173 pm).
Das dem SO2 entsprechende Molekül SeO2 ist nur in der Gasphase existiert. Aus IR-Spektren ist auch das Dimere (ebenfalls in der Gasphase) bekannt.
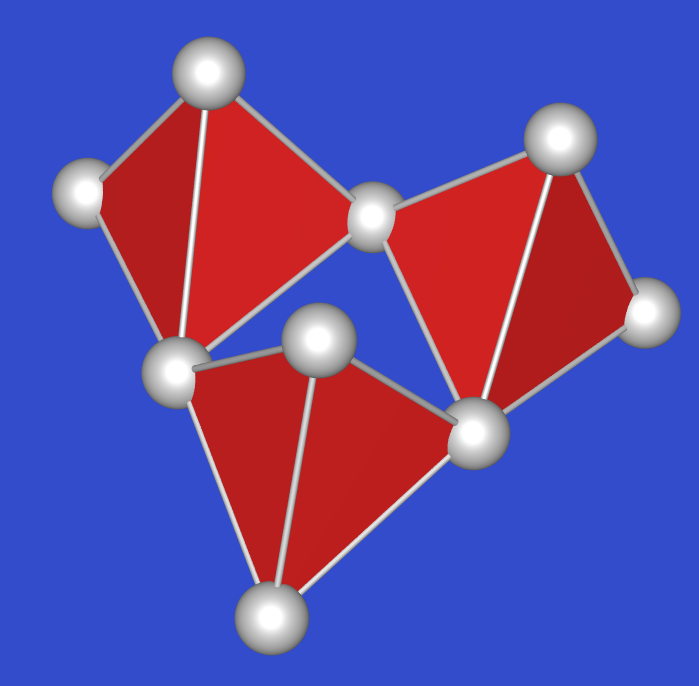
SeVIO3, das Anhydrid der Selensäure, läßt sich aus K3SeO4 und SO3 darstellten, da es ein stärkeres Oxidationsmittel als SO3 ist. Aus der so entstehenden Mischung von SeO3 und SO3 kann SO3 abdestilliert werden. SeVIO3 bildet farblose hygroskopische Kristalle mit einem Schmelzpunkt von 118 oC. Die Struktur (Abb. 2.7.2.) zeigt Se4O12-Tetramere gemäß [SeO2O(2/2)]4.
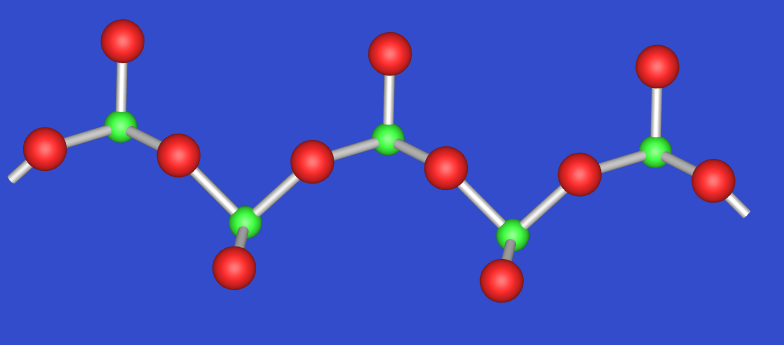
Das gemischtvalente SeIV,VI-Oxid Se2O5 entsteht durch thermische Zersetzung von SeO3. Mit Wasser entstehen entsprechend Selen- und selenige Säure. Die Struktur (s. Abb. 2.7.3.) enthält Ketten, die alternierend aus flachen Pyramiden SeIVOO2/2 und Tetraedern SeVIO2O2/2 bestehen.
Das Dioxid TeIVO2 bildet zwei verschiedene Modifikationen
(alpha- und ß-Form). In beiden ist Tellur vierfach koordiniert, wobei
die Geometrie entsprechend der stereochemischen Aktivität des Lone-Pair
einer ψ-trigonalen Bipyramide (vier O-Atome an den vier der fünf Ecken
einer trigonalen Bipyramide) entspricht.
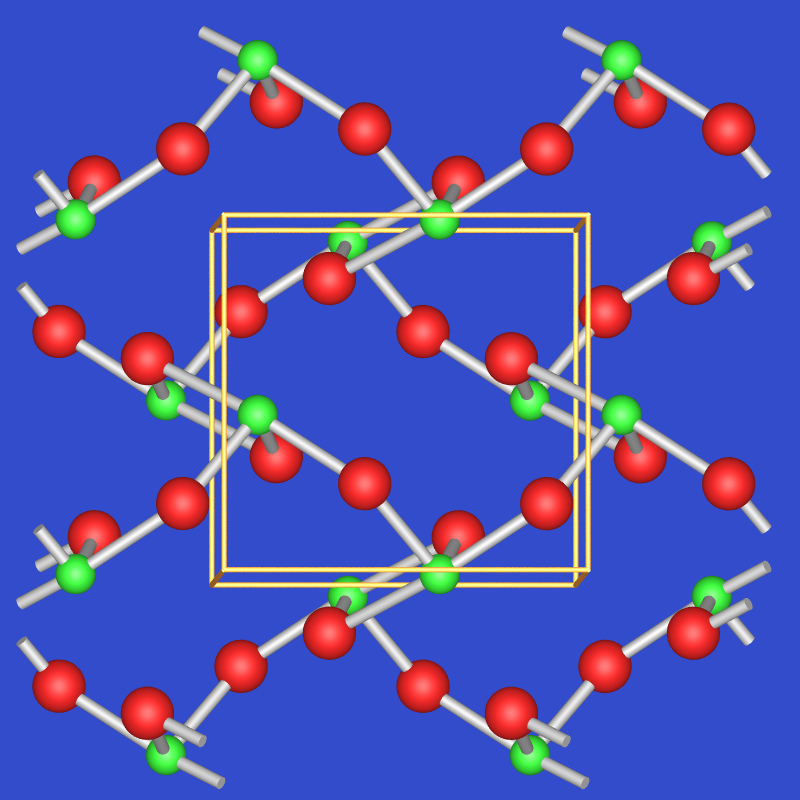
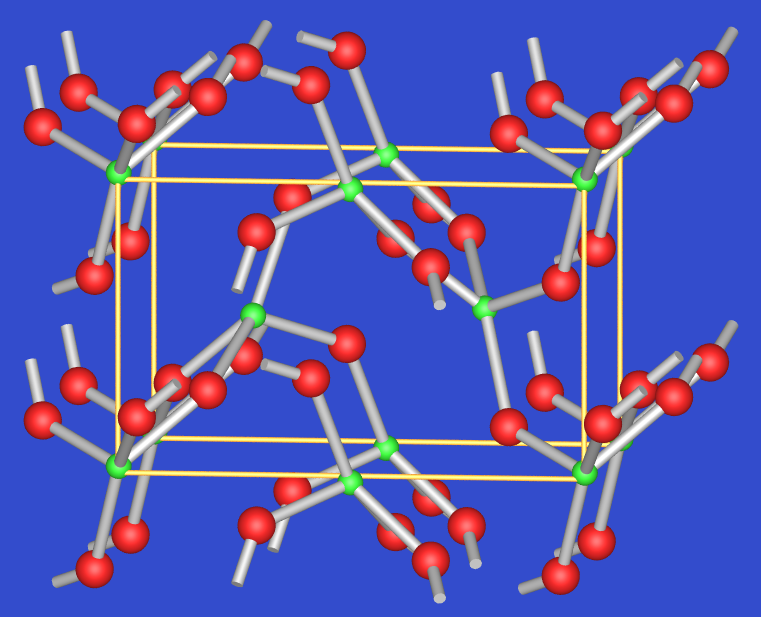
ß-TeO2 (Tellurit) (Abb. 2.7.4.)
kommt natürlich vor, läßt sich aber im Labor entweder aus den Elementen
oder durch Zersetzung des Nitrates herstellen.
Die gelbe, orthorhombische Hochdruckform
bildet eine Schichtstruktur aus kantenverknüpften
trigonalen Psi-Pyramiden.
Zwei ψ-Bipyramiden sind zunächst über eine Kante zu Dimeren verknüpft.
Diese sind über alle freien Sauerstoffatome
weiter verbunden: Te2O2O4/2.
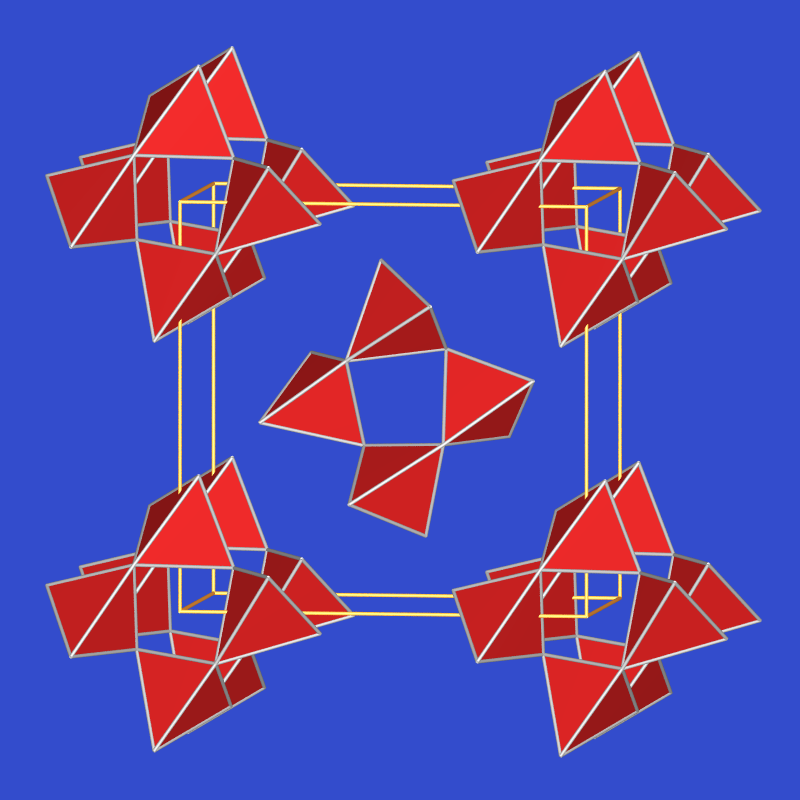
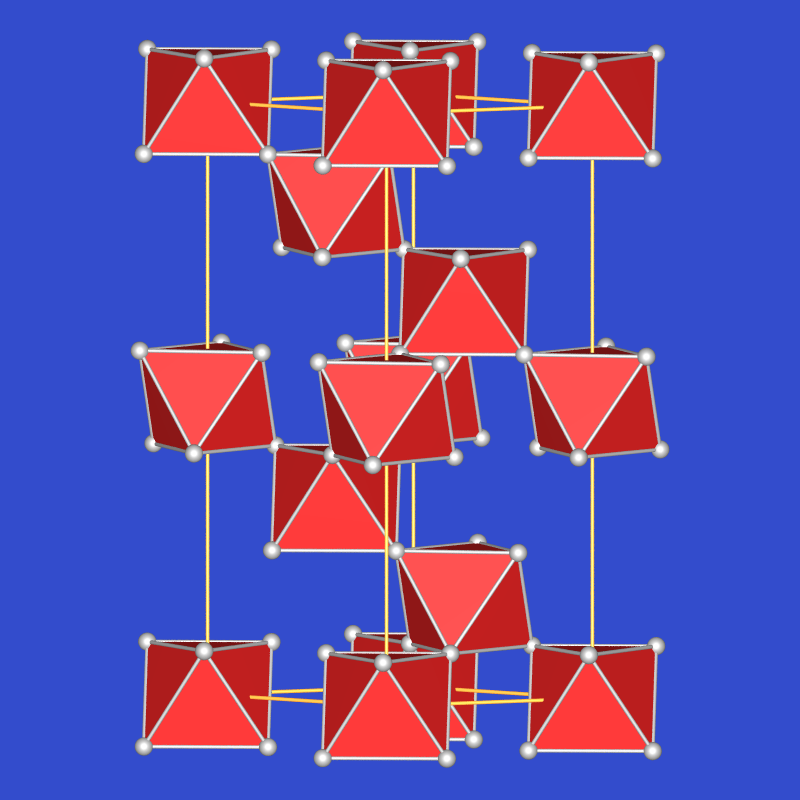
alpha-TeO2 (Paratellurit) (Abb. 2.7.5.)
kann nur künstlich hergestellt werden.
Er bildet farblose, tetragonale Kristalle mit Rutil-ähnlicher Struktur.
Die ψ-trigonalen Bipyramiden TeO4
sind im Paratellurit nicht nur zu Schichten, sondern dreidimensional verknüpft.
Daneben existiert ein Hochdruckphase von TeO2 mit einer CaCl2-verwandten Struktur.
 |
 |
 |
 |
| 2.7.4. Schichtstruktur von TeO2 (Tellurit) | 2.7.5. Raumnetzstruktur von TeO2 (Paratellurit) | 2.7.6. Struktur von TeO3 | 2.7.7. Struktur von Te2O5 |
TeVIO3 kommt ebenfalls in zwei Modifikationen vor: Die gelb-orange alpha-Form entsteht durch Entwässern von H6TeO6 mit konzentrierter H2SO4 bei 600oC und O2-Atmosphäre. Es liegt der VF3-Typ vor, der ähnlich wie ReO3 aus einem dreidimensionalen Verband aus über alle Ecken verknüpften Oktaedern aufgebaut ist (s. Abb. 2.7.6.). Der VF3- kann aus dem ReO3-Typ durch Verdrehung der Oktaeder um ihre dreizählige Achse abgeleitet werden.
Die graue alpha-Form von TeO3 kann aus der ß-Form in einem geschlossenen Rohr (12 h, O2-Atmosphäre, 300 oC) hergestellt werden.
Die Struktur des gemischtvalenten Oxids Te2O5 = TeIVTeVIO5 (Abb. 2.7.7.) besteht aus TeVIO6-Oktaedern, die über vier Ecken zu Schichen (wie SbV in Sb2O4) verknüpft sind (s. a. K2NiF4-Typ). Die TeIV-Atome befinden sich zwischen den Schichten in der typischen ψ-trigonal-bipyramidalen Koordination durch Sauerstoff.
Ein weiteres gemischtvalentes Oxid ist Te4O9 (TeIV3TeVIO9) mit einer komplizierten Struktur aus TeIV Oktaederschichten und Ähnlichkeiten mit Te2O5.
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |