| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
Schon aus der Gliederung geht indirekt hervor, dass die chemische Bindung wesentlich die Struktur bestimmt. Der Umkehrschluß, nach dem gleiche Struktur auch gleiche Art der chemischen Bindung bedingt, gilt übrigens nicht immer, wie einige berühmte Beispiele zeigen: Beispielsweise sind die Legierung CuZn (metallische Bindung) und der Ionenkristall CsCl isotyp! Bekanntermaßen ist das chemische Hauptkriterium für die Bindungsart
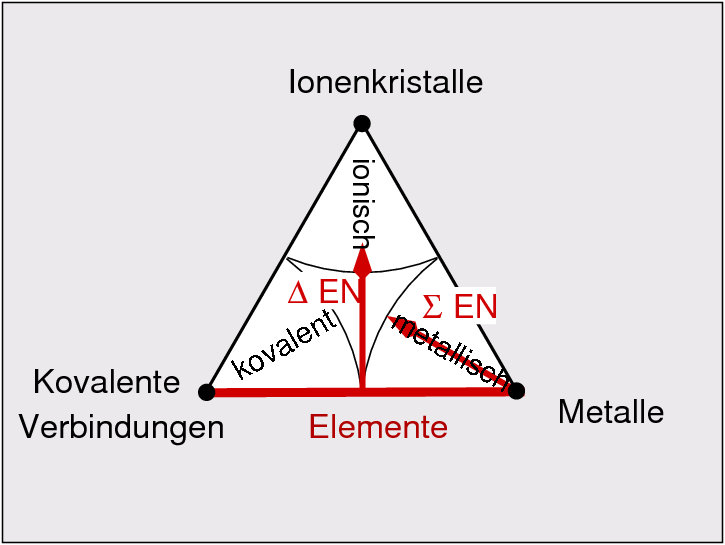
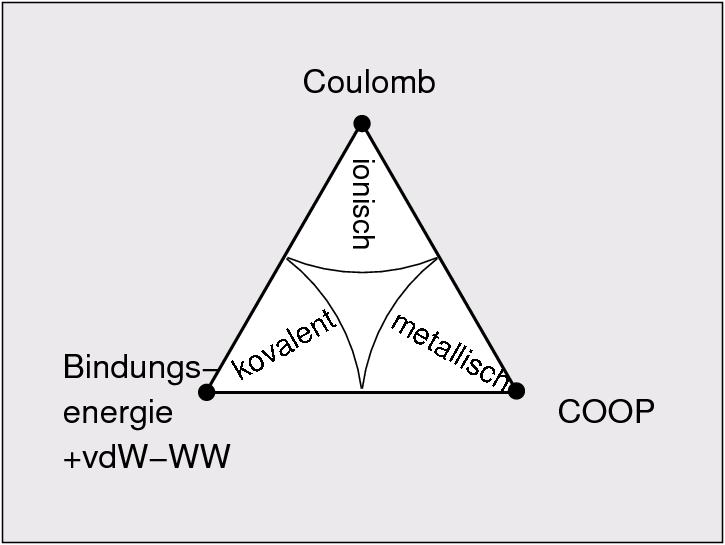
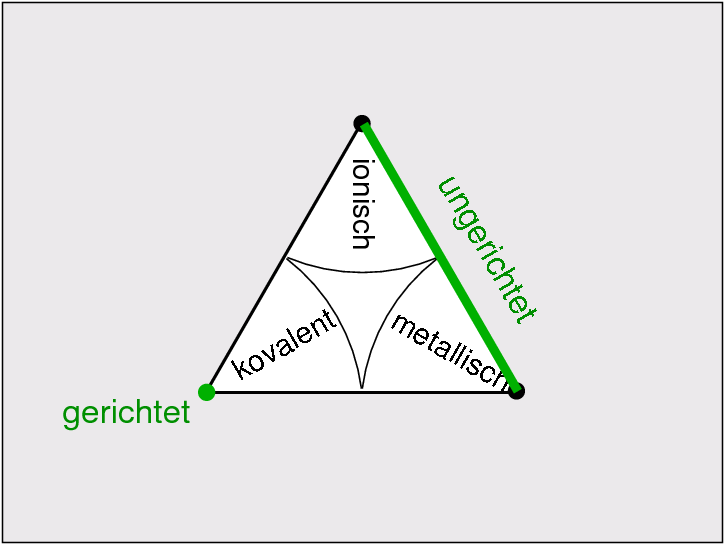
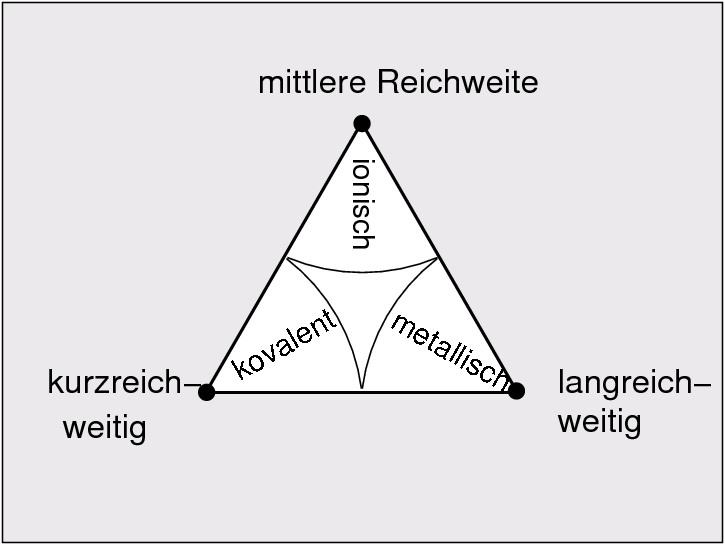
Am besten lassen sich die verschiedenen Punkte im Dreieck der Bindungsarten (Ketelaar-Dreieck) demonstrieren:
| 1. Bindungsarten und Elektronegativität | 2. Energieinhalt/Gewinn bei der Bildung | 3. Bindung |
|---|---|---|
 |
 |
 |
| SVG | SVG | SVG |
 |
 |
 |
| 4. Reichweite der chemischen Bindung | 5. Koordinationszahlen (CN) | 6. Darstellung der Strukturen |
|---|---|---|
 |
 |
 |
| SVG | SVG | SVG |
Wichtigste strukturchemische Folge der Bindungsart sind die stark variierenden
| 7. Größen und Radien | 8. Kapiteleinteilung | 9. Konzepte zum Strukturverständnis |
|---|---|---|
 |
 |
 |
| SVG | SVG | SVG |
| . | Bindungstyp | Diagramm | ||
|---|---|---|---|---|
| kovalent | ionisch | metallisch | ||
| Summe EN | groß | mittel | klein | 1 |
| Differenz EN | klein | groß | klein | |
| Energie-Gewinn | LCAO (je 2 AO) | IE, EA, Coulomb | LCAO (alle AO) | 2 |
| Reichweite | kurz (2 Atome) | mittel | lang (ges. Kristall) | 3 |
| Bindung | gerichtet | ungerichtet | ungerichtet | 4 |
| CN | 1 bis 4 | 4 bis 8 | 8 bis 24 | 5 |
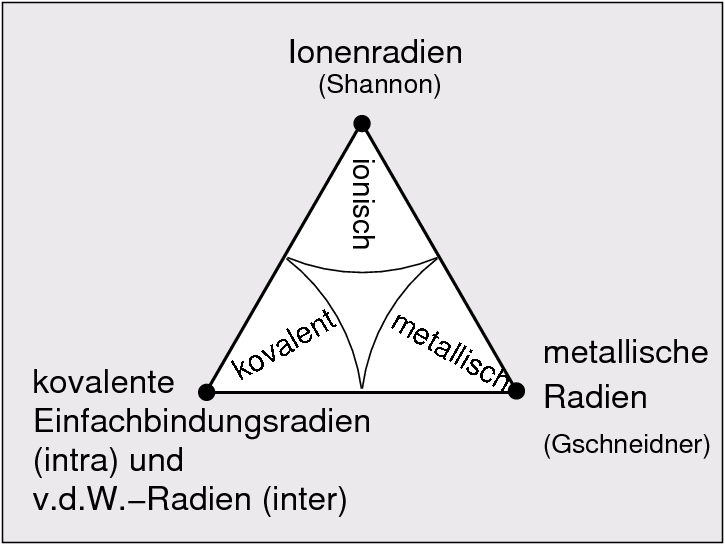
| Radien | kov. Einfachbindungsradien, v.d.W.-Radien | Ionenradien | metallische Radien (Gschneidner) | 7 |
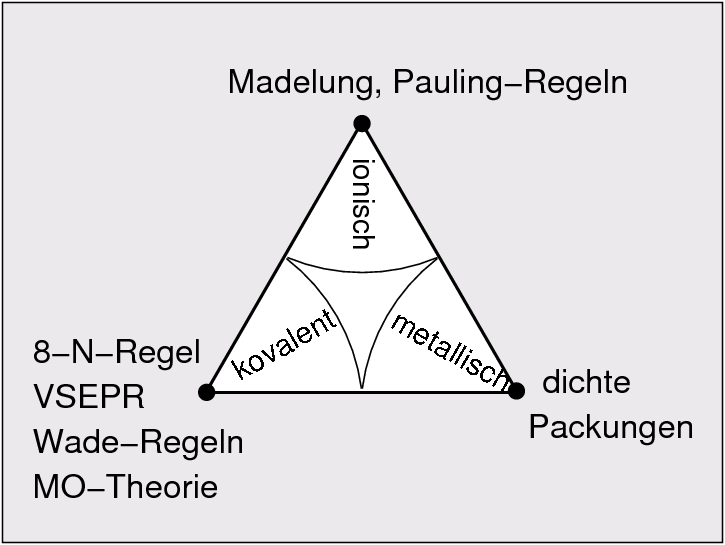
| einfache Struktur-Konzepte | 8-N-Regel, VSEPR, Wade-Regeln | Pauling-Regeln, dichte Packungen der Anionen mit besetzten Lücken | dichteste Packung | 9 |
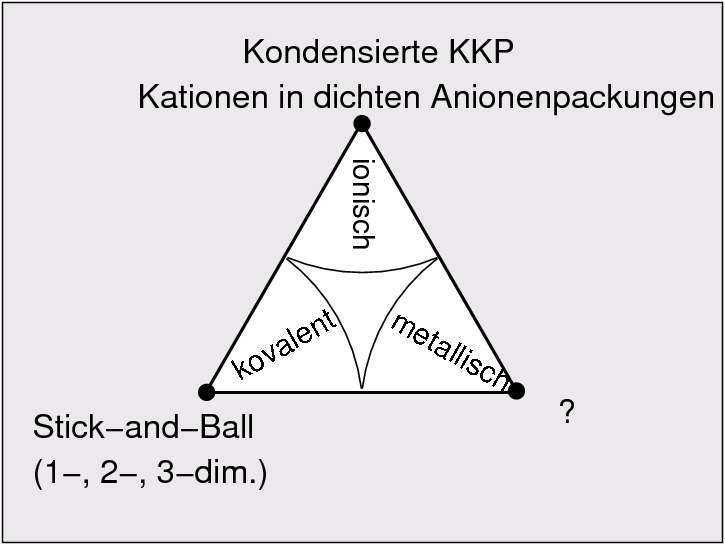
| Darstellung der Struktur | Stick-and-Ball, Kalotten-Modelle | KKP | ? | 6 |
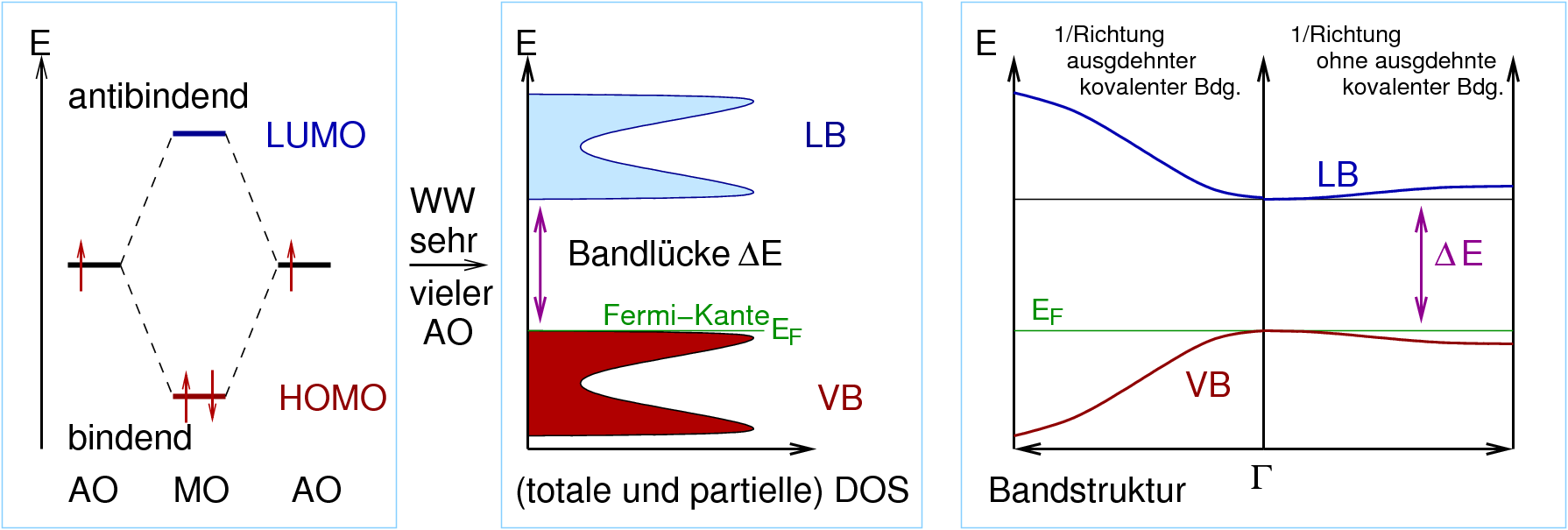
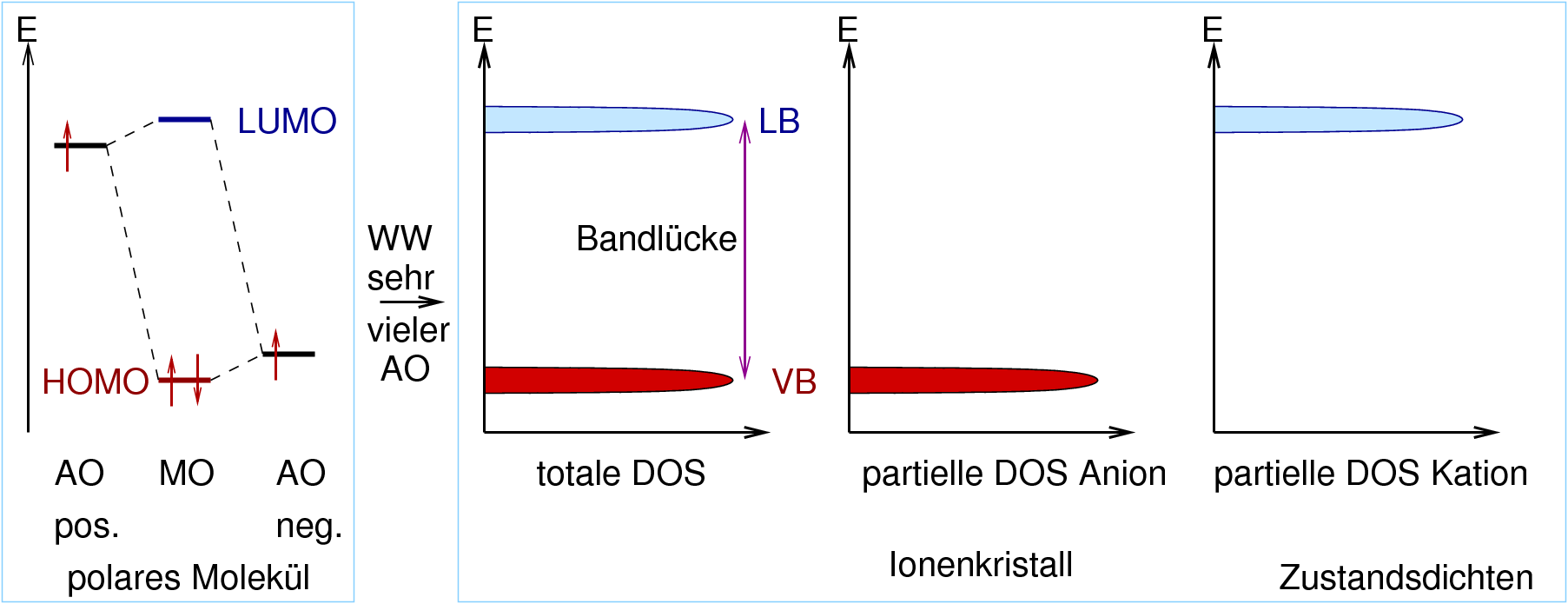
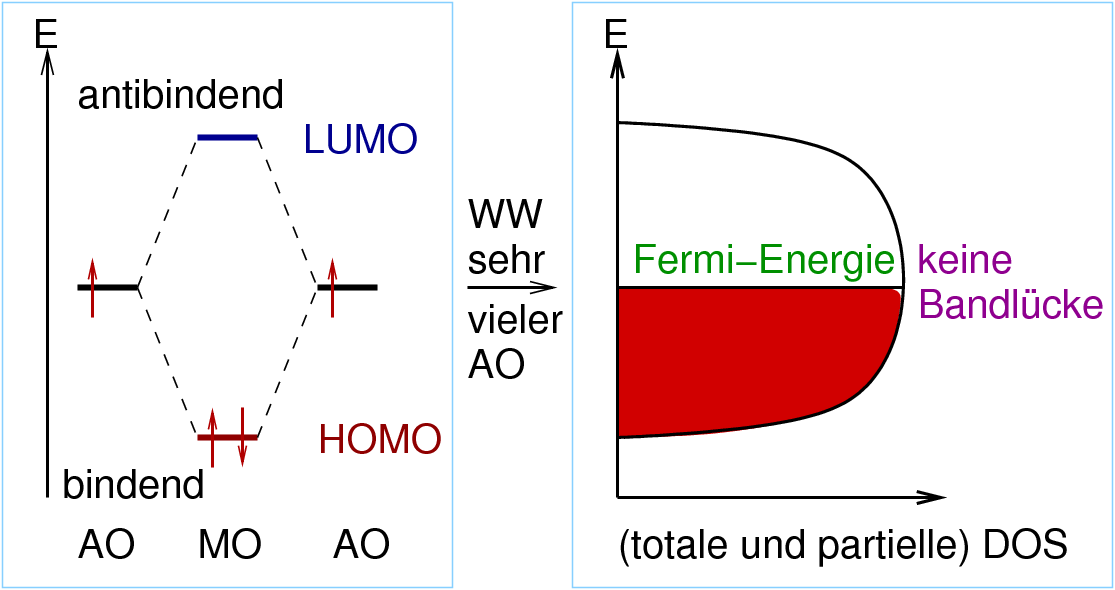
| elektronische Struktur. Zustandsdichten | mittlere bis kleine Bandlücken, DOS bei EF=0 | sehr große Bandlücken | keine Bandlücke, hohe DOS bei EF | - |
| Eigenschaften | meist anisotrop | selten anisotrop | isotrop | - |
| Bauverbände | 1-, 2- oder 3-dimensional | meist 3-dimensional | 3-dimensional | - |
| mechanische Eigenschaften bei 3-dim. Verbänden | sehr hart | hart, spröde | duktil | - |
| elektrische Eigenschaften bei 3-dim. Verbänden | Isolatoren bis Halbleiter | Isolatoren | Leiter | Bandlücken |
| Besprechung in | Kapitel 2 | Kapitel 3 | Kapitel 4 | 8 |
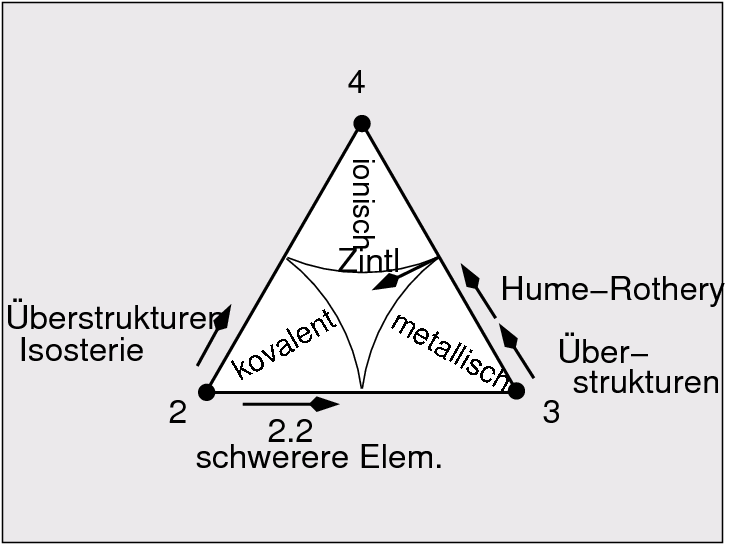
| Besonders interessant sind natürlich die Übergänge zwischen den Bindungsarten und -konzepten! |
Beispiel: Elemente der 3. Periode (nur Hauptgruppen) mit jeweils einer charakteristischen Verbindung des entsprechenden binären Systems
| NaCl | ||||||||||||
| MgCl2 | Na2S | |||||||||||
| AlCl3 | MgS | NaP | ||||||||||
| SiCl4 | Al2S3 | MgP | NaSi | |||||||||
| PCl3 | SiS2 | AlP | Mg2Si | NaAl | ||||||||
| SCl2 | P4S6 | - | - | MgAl2 | NaMg | |||||||
| Cl2 | S8 | P4 | Si | Al | Mg | Na | ||||||
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |