Vorlesung Anorganische Strukturchemie
1. Einleitung
1.3. Systematik, Beschreibung, Nomenklatur
Zur Verständigung zwischen anorganischen Strukturchemikern
ist ein minimaler Satz bekannter sogenannter Strukturtypen
(einzelne, ungeordnet) erforderlich.
- bestimmte Atomanordnung in einem kristallinen Festkörper
- Isotypie: gleiche Raumgruppe, ähnliche Gitterkonstanten, ähnliche Lageparameter (Kriterien?, vgl. Typix)
- Name: nach der zuerst strukturell charakterisierten Verbindung, z.B.
NaCl/Kochsalz-Typ, Cu-Typ usw. Dadurch ist leider die Namensgebung sehr uneinheitlich,
h&auuml;fig liegen Mineral-Namen (Spinell),
Entdeckernamen, Ortsbezeichnungen (Perowskit), Eigenschaften,
Kristallformen (Tridymit), Spaltbarkeiten, Farben, etc. etc.
den Namen zugrunde.
Die einzelnen Strukturtypen können unter verschiedenen Aspekten
geordnet und gruppiert werden:
- Der Gruppierung nach chemischen Kriterien folgt die sogenannte
Strukturberichtsnomenklatur, die in Tab. 1.3.1. für einige bekannte Beispiele
zusammengestellt ist.
| Gruppe |
Verbindungen |
Beispiele |
| A |
Elemente |
A1: f.c.c., Cu-Typ |
| A2: b.c.c., W-Typ |
| A3: h.c.p., Mg-Typ |
| A4: Diamant |
| A5: weißes Sn |
| A14: I2 |
| B |
Verbindungen des Formeltyps AB |
B1: NaCl |
| B2: CsCl |
| B12: BN |
| C |
Verbindungen des Formeltyps AB2 |
C1: CaF2 |
| C4: TiO2 |
| C6: CdI2 |
| D |
Verbindungen des Formeltyps AmBn |
D1: NH3 |
| E |
Verbindungen mit mehr als zwei Atomsorten ohne zusammengehörige Baugruppen |
E1: PbFCl |
| F |
Verbindungen mit mehr als zwei Atomarten mit zusammengehörigen Baugruppen aus zwei oder drei Atomen |
F1: KCN |
| G |
Verbindungen mit vieratomigen Baugruppen |
G1: MgCO3 |
| H |
Verbindungen mit fünfatomigen Baugruppen |
H2: BaSO4 |
| L |
Legierungen |
L10: CuAu |
| M |
Mischkristalle |
|
| O |
Organischen Verbindungen |
O1: CH4 |
| S |
Silicate |
|
Tab. 1.3.1. Strukturberichts-Nomenklatur
- Für die kristallographische Ordnung von
Strukturen gibt verschiedene Ansätze, z.B.
wird z.T. der sogenannte Pearson-Code verwendet, in dem die
Strukturtypen nach Kristallklassen/Bravais-Gitter geordnet und
durch die Zahl der Atome in der Elementarzelle weiter unterschieden werden
(z.B. CsCl: cP2).
- Die Symmetrie der Kristallstrukturen kann sehr günstig
als Ordnungsprinzip genutzt werden. Die mathematisch genaue
Beschreibung mit Hilfe der Gruppentheorie (Gruppe-Untergruppe-Beziehung)
ist dabei sehr nützlich. Die Prinzipien hiervon (ohne die Mathematik!)
werden auch an einzelnen Stellen in dieser Vorlesung genutzt und verbergen
sich z.B. auch hinter Begriffen wie:
- Ordnungsvarianten (Homöotype) (Po: NaCl, Si: GaAs, Cu: CuAu, Cu3Au)
- Defektvarianten (NaCl: CdCl2) bzw. gestopfte Varianten
- Verzerrungsvarianten (Po: Te, As)
- Stapelvarianten (Polytype) (ClI2 - CdCl2)
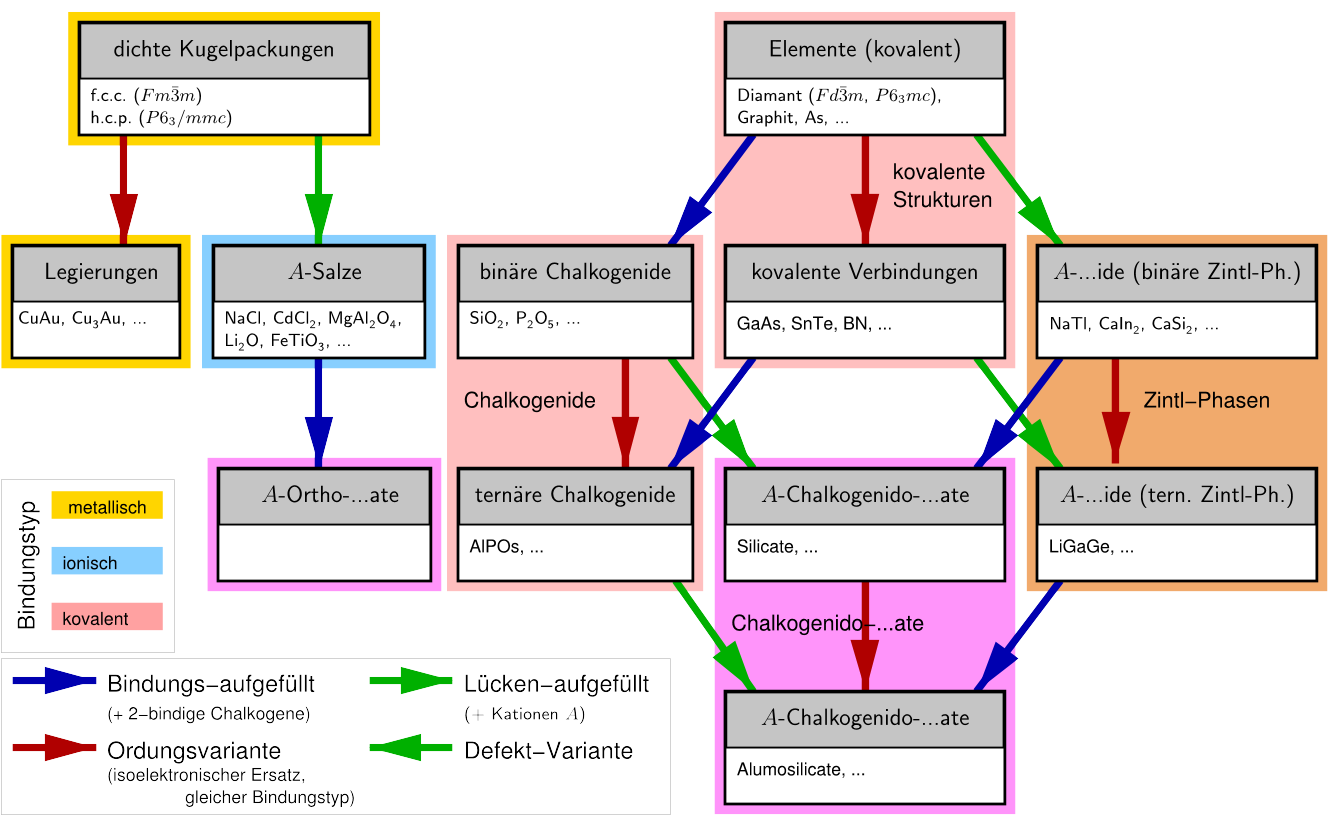
Diese und viele andere nützliche Zusammenhänge, die unten im Detail
besprochen werden, sind auf der Vorlage 1.3.
grafisch zusammengestellt.
Verschiedene Formelschreibweisen geben auch Hilfen zum Aufbau der Strukturen:
- Vorangestellte Dimensionalität: 2∞ C (für Graphit)
- Hochgestellte eckige Klammern zur Kennzeichnung der Koordinationszahlen:
z.B. C[3] im Graphit oder Na[6]Cl[6] für
Kochsalz.
- Der Kondensationsgrad der Polyeder (meist der Kationenkoordinationspolyeder in
Salzen) kann als gebrochene Indizes angedeutet werden (sog. Niggli-Formeln, s. Video), z.B.
- SiO4/2 für Quarz um anzudeuten, dass jedes Si-Atom von vier
Sauerstoffatomen umgeben ist, die aber jeweils zu zwei KKPs gehören.
| ✍Video zur Niggli-Schreibweise(175MB|MP4|H264) |
|
Generelle Zusammenhänge zwischen Basisstrukturen
Die Zusammenhänge zwischen den Basisstrukturen der Metalle (links) und der
kovalenten Elemente (rechts) und sehr vielen anderen Verbindungsklassen sind
im Diagramm in Abbildung 1.3.1. zusammengestellt. In der Tonspur (C-20/21 geschuldet!)
gibt es eine Erklärung dazu.
Abb. 1.3.1. Generelle Strukturzusammenhänge
‣SVG