| ⚗ Verbrennung von Lithium an Luft, Nachweis des Nitrids (Ammoniak) (53MB|MP4|H264) |
- Peroxide mit O22--Ionen,
- Hyperoxide (Superoxide) mit O2--Ionen,
- Sesquioxide mit O22-- neben O2--Ionen und
- Ozonide mit Ozonid-Ionen O3-.
| Formel | Name | Anion | dO-O | Beispiel | Darstellung (Farbe) |
|---|---|---|---|---|---|
| MI2O2 | Peroxide | O22- | 149 | Na2O2 | Na, (K): Verbrennen der Elemente an Luft |
| MIO2 | Hyperoxide (Superoxide) | O2- | 133 | KO2 | K, Rb, Cs: Verbrennen der Elemente an Luft |
| MI4O6 | Sesquioxide | O22- und O2- | . | K4O6 | (schwarz) |
| MIO3 | Ozonide | O3- | 135 | RbO3, CsO3 | Umsetzung der Hydroxide mit Ozon (orange/rot) |
Zu den einzelnen Verbindungsgruppen:
- Die Peroxide enthalten das Ion O22-
mit einem einer O-O-Einfachbindung entsprechenden Abstand von 149 pm
(Isosterie zu den Halogenen).
Sie sind als Salze der zweibasigen Säure H2O2
aufzufassen und reagieren entsprechend unter einfacher Hydrolyse mit Wasser zu Wasserstoffperoxid.
Alkalimetallperoxide M2O2 sind von allen Alkalimetallen bekannt. Es handelt sich um weiße bis gelbliche Feststoffe, die mit der Ausnahme von Li2O2 bis zu hohen Temperaturen stabil sind. Sie lassen sich auf unterschiedliche Weise herstellen:
- Li2O2 läßt sich aus LiOH und H2O2 herstellen.
- Na2O2 entsteht bei der einfachen Verbrennung von Natrium.
⚗ Verbrennung von Natrium, Nachweis der Peroxid-Ions mit Titanyl-Sulfat (40MB|MP4|H264)
- Die Peroxide der schwereren Alkalimetalle lassen sich durch Oxidation der Metalle in flüssigem Ammoniak gewinnen.
Na2O2 + CO ⟶ Na2CO3 bzw.Na2O2 + CO2 ⟶ Na2CO3 + 1/2 O2 sowohl CO binden, als auch mit CO2 Sauerstoff entwickeln. Die Strukturvielfalt in dieser Gruppe ist relativ groß (s. Kap. 3.1. der Vorlesung Strukturchemie der Oxide). - Die Hyperoxide (auch Superoxide) enthalten das paramagnetische
Ion O2- mit einem ungepaarten Elektron.
Der O-O-Abstand entspricht mit 128 pm einer Bindungsordnung von 1.5 und
ist damit z.B. vergleichbar mit dem im Ozon. Der
Sauerstoff-Sauerstoff-Abstand im Element O2 beträgt dagegen 121 pm.
Die Alkalimetallsuperoxide MO2 sind von allen
Alkalimetallen außer Lithium bekannt.
NaO2 läßt sich aus den Elementen nur unter Druck rein
darstellen, während die der schwereren Metalle bei der Oxidation der
Metalle direkt gebildet werden.
Die Hyperoxide disproportionieren in Wasser gemäß
2 -0.5O2- + 2 H2O ⟶ O02 + H2O-12 + 2 O2-H- Ihre Strukturchemie ist in Tabelle 2.4.2 zusammengefaßt. Bei den Hochtemperaturphasen sind meist die Anionen fehlgeordnet, bei niedrigeren Temperaturen ordnen sie aus und bilden bekannte Strukturtypen wie den Calciumcarbid-, den Pyrit- oder den Markasit-Typ (s.u.).Verbindung Farbe Modifikation T-Bereich Struktur GIF NaO2 weiss α < -77 oC Markasit (FeS2) 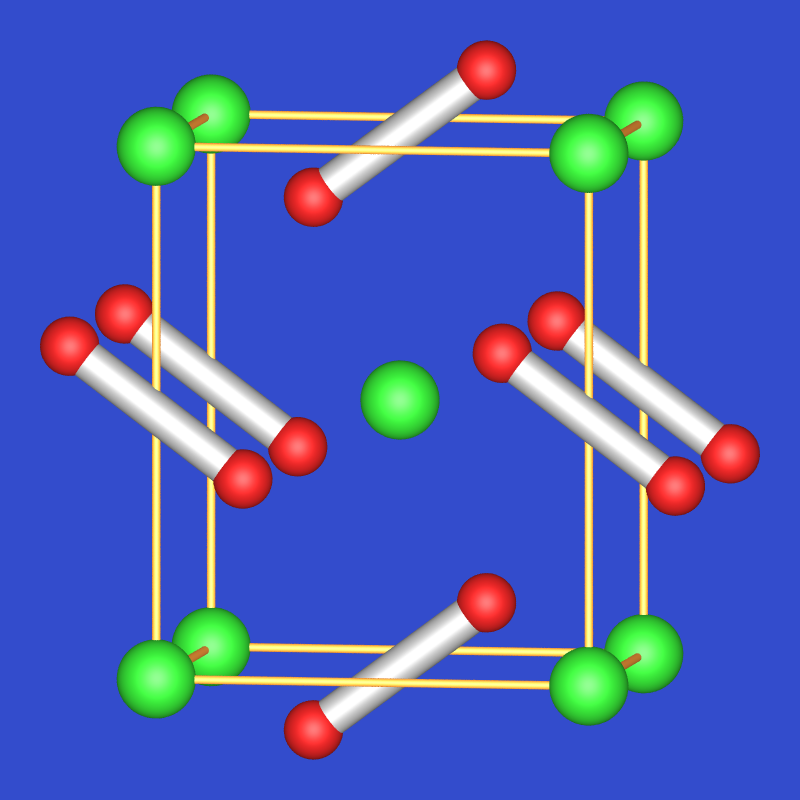
β -77 bis -50 oC Pyrit (FeS2 
γ > -50 oC NaCl (fehlgeordnete O2) KO2 gelb, s. Abb. 2.4.1. für alle drei schwereren Alkalimetalle RT CaC2-Typ 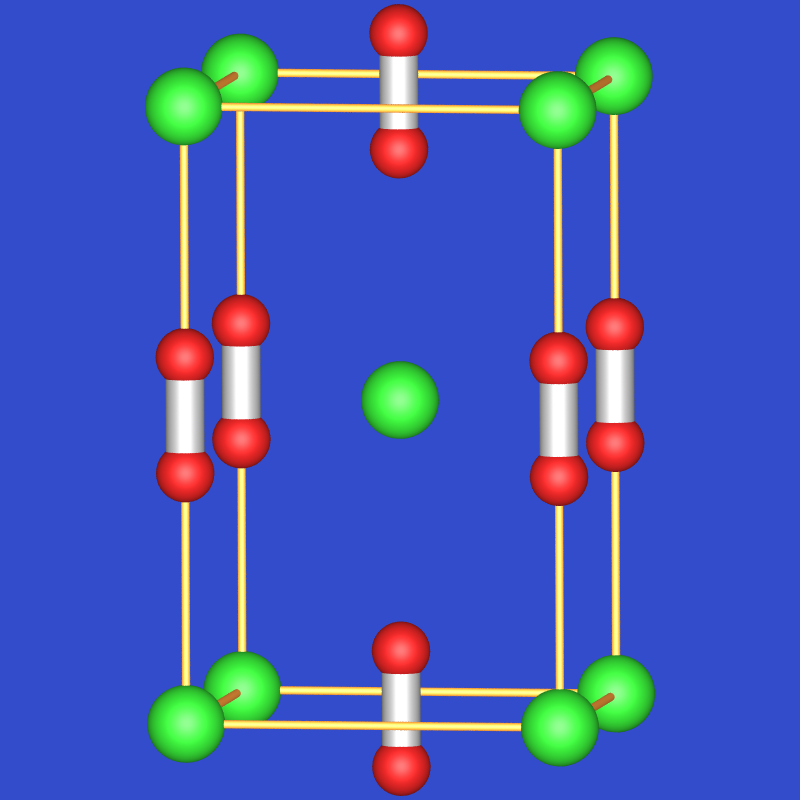
RbO2 braun CsO2 orange HT NaCl (fehlgeordnete O2) Tab. 2.4.2. Übersicht zu Alkalimetall-Hyperoxiden

Abb. 2.4.1. Kaliumperoxid, KO2. - Die Sesquioxide
enthalten die Anionen der Peroxide und Hyperoxide
nebeneinander (O22- und
O2-).
Die Verbindungen der Zusammensetzung M4O6 entsprechend MI4(O2-)2(O22-) sind nur für M = Rb und Cs bekannt. Die schwarzen paramagnetischen Substanzen kristallisieren in der kubischen anti-Th3P4-Struktur. Da die Positionen der Ionen O2- und O22- symmetrieäquivalent sind, sind sie im Kristall nicht unterscheidbar. - Ozonide
enthalten das Ozonid-Ion O3-.
MI-Ozonide MO3 sind nur für die schwereren
Alkalimetalle Kalium, Rubidium und Caesium bekannt. Die Verbindungen bilden orange-rote Kristalle,
die sich aus O3 und dem Hydroxid herstellen lassen.
Ozonide disproportionieren in Wasser gemäß:
2 -1/3O3- + H2O ⟶ 5/2 OO2 + 2 OH-
Die bekannten Verbindungen und die darin enthaltenen Cluster zeigt Tabelle 2.4.3.
| Cluster | Formel | Verbindung | formale Zerlegung | Farbe | Mp | Bildchen |
|---|---|---|---|---|---|---|
| zwei flächenverknüpfte Oktaeder | M9O2 | Rb9O2 | - | kupferfarben | 40.2oC | |
| Rb6O | 2*: ↝ 3 M + M9O2 | bronzefarben | Zp: 7 oC | 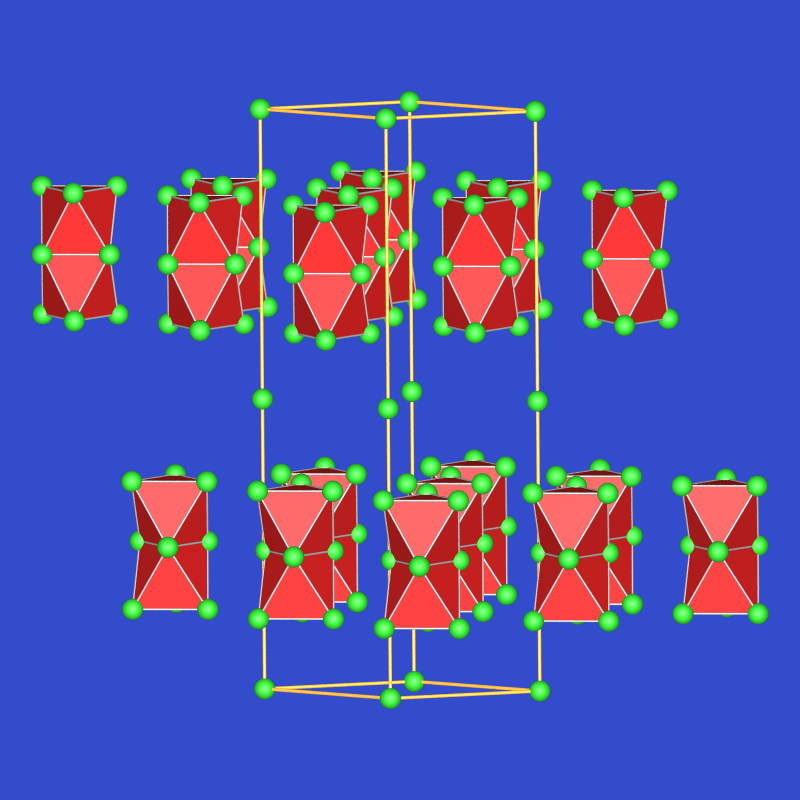 |
||
| drei flächenverknüpfte Oktaeder | M11O3 | Cs11O3 | - | violett | 52oC |  |
| Cs4O | 3*: ↝ M + M11O3 | rotviolett | Zp=10oC | |||
| Cs7O | 3*: ↝ 10 M + M11O3 | bronzefarben | 4.3 oC | |||
| Oktaederketten | M3O | Cs3O | anti-ZrI3-Typ | blaugrün | Zp=166 oC | 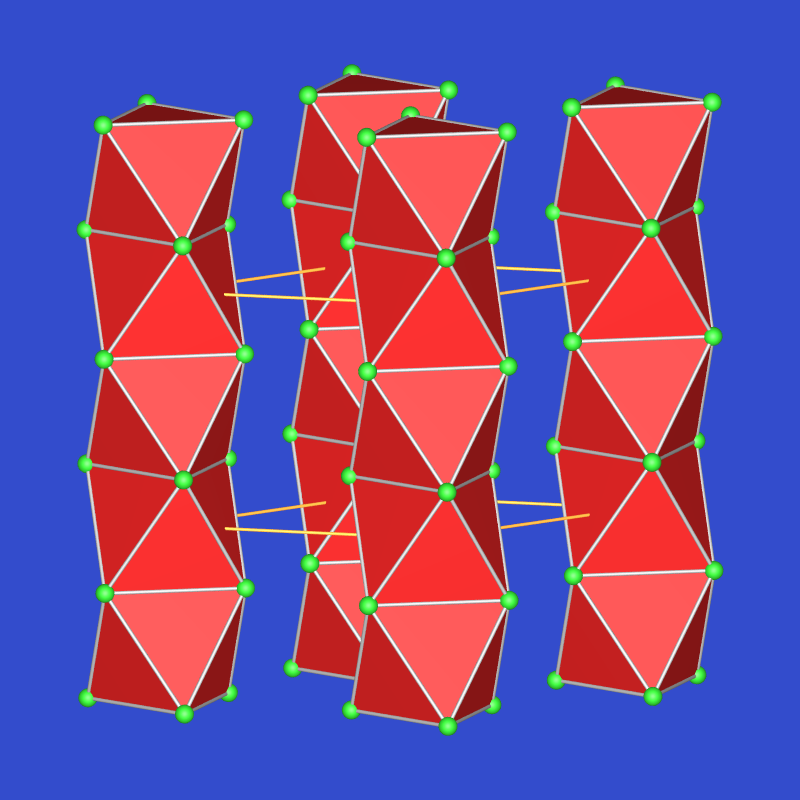 |
Alle Rubidium-Suboxide enthalten demnach Cluster Rb9O2 aus zwei über eine gemeinsame Fläche kondensierten Oktaedern, in den meisten Caesium-Suboxiden liegt ein Cluster der Zusammensetzung Cs11O3 vor, der aus drei über drei gemeinsame Flächen und eine gemeinsame Kante verknüpften [OCs6]-Oktaedern aufgebaut ist. Cs3O kristallisiert im anti-ZrI3-Typ und enthält Stränge flächenverknüpfter Sauerstoff-zentrierter Cs-Oktaeder. Ähnliche ungewöhnliche Verbindungen wie die Suboxide der schweren Alkalimetalle gibt es z.B. bei den Na-Ba-Subnitriden. Die Verbindungen sind nicht nur aufgrund ihrer ungewöhnlichen Bindungssituation, sondern auch anwendungstechnisch interessant und werden wegen der geringe Austrittsarbeit für Elektronen z.B. in IR-Detektoren eingesetzt.