Vorlesung Chemie der Metalle
2. Alkalimetalle (1. Hauptgruppe: Li, Na, K, Rb, Cs)
2.3. Halogenide
Die Alkalimetallhalogenide sind die typische Ionenkristalle, da hier eine maximale Differenz
der Elektronegativitäten vorliegt. Sie haben hohe Schmelzpunkte zwischen 500 und 1200oC.
Die Schmelzpunkte fallen von den Fluoriden bis zu den Iodiden.
Alle Halogenide (außer CsCl, CsBr und CsI) kristallisieren
im NaCl-Typ.
An dieser Stelle sollen trotzdem die drei wichtigsten Strukturen von Ionenkristallen AB
eingeführt werden
Eine genauere Einführung zur Strukturchemie von Ionenkristallen gibt es in Kap. 4.
der Vorlesung Anorganische Strukturchemie.
Strukturbestimmend für die drei Typen ist das Radienverhältnis
rKation/rAnion. Die Änderung der Koordinationszahl und damit des
Strukturtyps mit diesem Verhältnis läßt sich unmittelbar veranschaulichen:
| CN (A bzw. K) |
8 |
6 |
4 |
| rKation/rAnion |
> 0.73 |
> 0.73-0.41 |
> 0.41-0.22 |
| Kationen-Koord. |
 |
 |
 |
| VRML I |
Kationen-Koordination |
Kationen-Koordination |
Kationen-Koordination |
| Elementarzelle |
 |
 |
 |
| Elementarzelle (VRML) |
mit Kugeln |
mit Kugeln und
in Polyederdarstellung (Kationenkoordinationspolyeder) |
mit Kugeln und
in Polyederdarstellung (Kationen-Koordinationspolyeder) |
| VRML II |
Elementarzelle
| Elemenatarzelle mit Kugeln und in
Polyederdarstellung |
Elementarzelle mit Kugeln und in
Polyederdarstellung |
| Strukturtyp (Links zur ST-DB) |
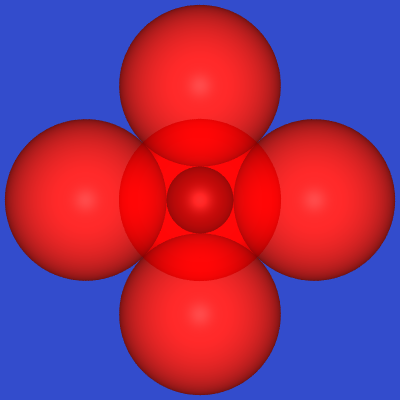
CsCl-Typ |
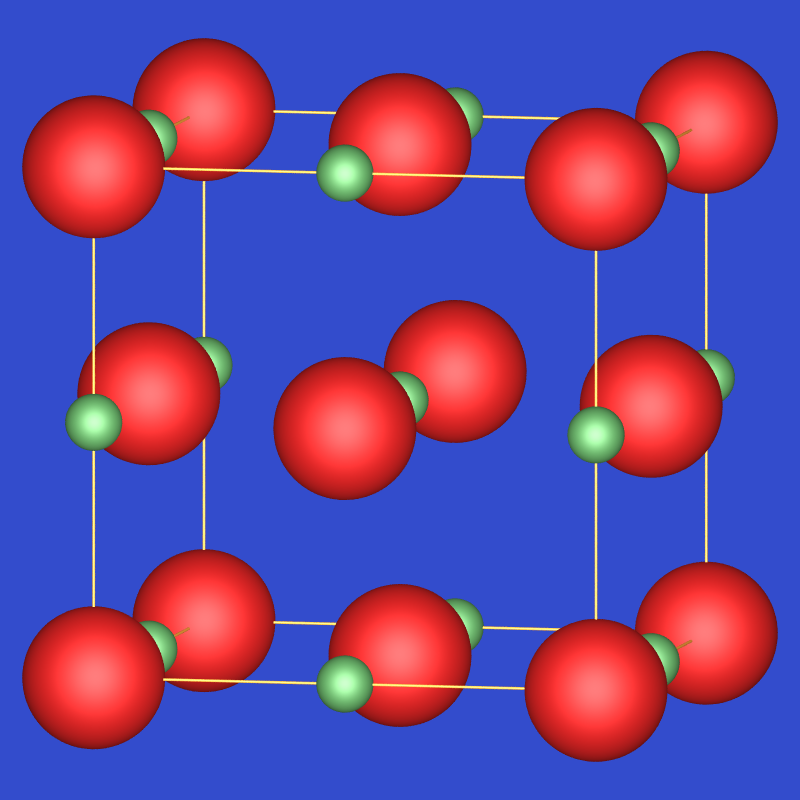
NaCl-Typ |
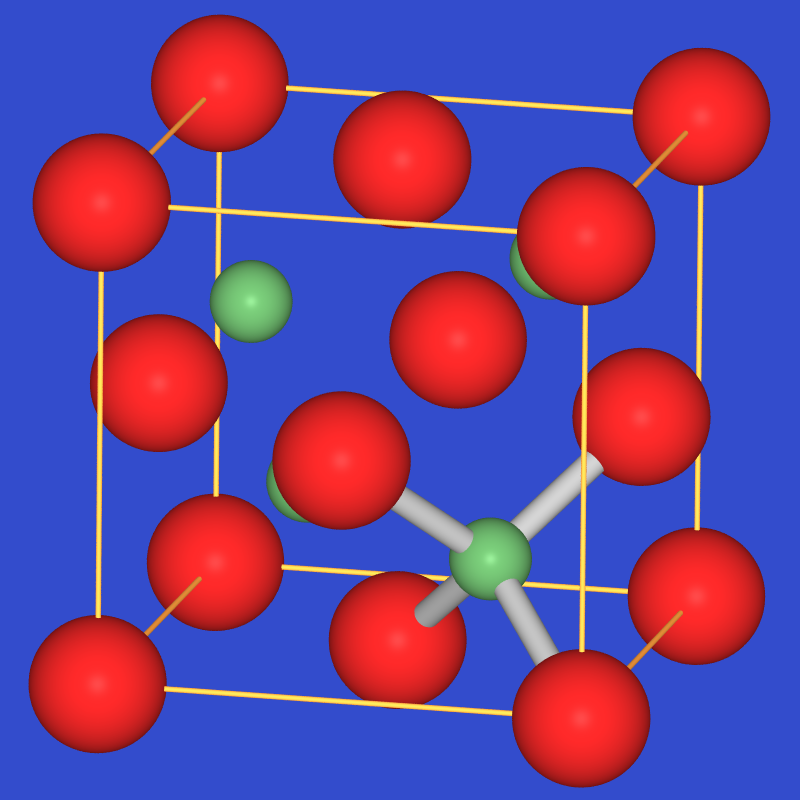
Zinkblende-Typ |
| MI-Halogenide |
CsCl, CsBr, CsI |
LiF, LiCl, NaF, NaCl, KF, KCl, RbF, RbCl, CsF |
- |
| MII-Chalkogenide |
- |
MgO, CaO, SrO, BaO, CaS, SrS |
BeS, BeSe (BeO und MgTe: verwandt, aber hexagonaler Wurtzit-Typ) |
| MIII-Pentelide |
- |
- |
c-BN, AlP, GaAs, InSb etc. (AlN: verwandt, aber hexagonaler Wurtzit-Typ) |
Tab. 2.3.1. Strukturen der Alkalimetall-Halogenide (AB-Ionenkristalle)
-
Bei im Verhältnis zu den Anionen relativ großen Kationen
(theoretisches Radienverhältnis rKation/rAnion > 0.73)
können acht Anionen würfelförmig um ein Kation angeordnet werden (CN 8) .
Wegen der 1:1-Zusammensetzung müssen umgekehrt auch acht Kationen um ein Anion angeordnet sein.
Die Geometrie der Koordination entspricht einem Kubus von Anionen um das Kation (und umgekehrt).
Der zugehörige Strukturtyp ist der CsCl-Typ,
der in der Reihe der Alkalimetallhalogenide für CsCl (0.92), CsBr (0.85) und CsI (0.76) vorkommt
(in Klammern die Radienverhältnisse, ermittelt aus den Shannon-Radien).
CsF kristallisiert
dagegen im NaCl-Typ (s.u.). Da die Kationen hier schon größer sind als die Anionen
muss man von einer dichtesten Kationenpackung ausgehen und den Kehrwert des
Radienquotienten (für CsF statt 1.25 also 0.8) als Radienquotient ansetzen.
Dieser liegt schon im Stabilitäsfeld des NaCl-Typs.
Die beiden anderen Strukturen von Ionenkristallen lassen sich vereinfachen, wenn eine
Erweiterung der bereits bei den einfachen Metallpackungen
(s. Kapitel 1.4.) dieser Vorlesung)
begonnen Betrachtungen vorgenommen wird.
Die beiden folgenden Strukturen lassen sich nämlich aus der kubisch dichtesten Packung der
Anionen ableiten, in denen ein Teil der Lücken von den Kationen besetzt sind. Daher ist also
die Betrachtung der Art (1) und Zahl (2) der Lücken in dichten Packungen erforderlich:
- Bereits zwei gemäß AB zueinander angeordnete Schichten reichen zur Erklärung der auftretenden
Lücken aus. Der Abbildung 2.3.1. ist zu entnehmen, dass
tetraedrische und oktaedrische Lücken vorhanden sind.
Der freie Radius beträgt für die Tetraederlücke 0.225*rKugel,
für die Oktaederlücke 0.414*rKugel, Oktaederlücken
sind also erheblich (! etwa Faktor 2 !) größer als Tetraederlücken.
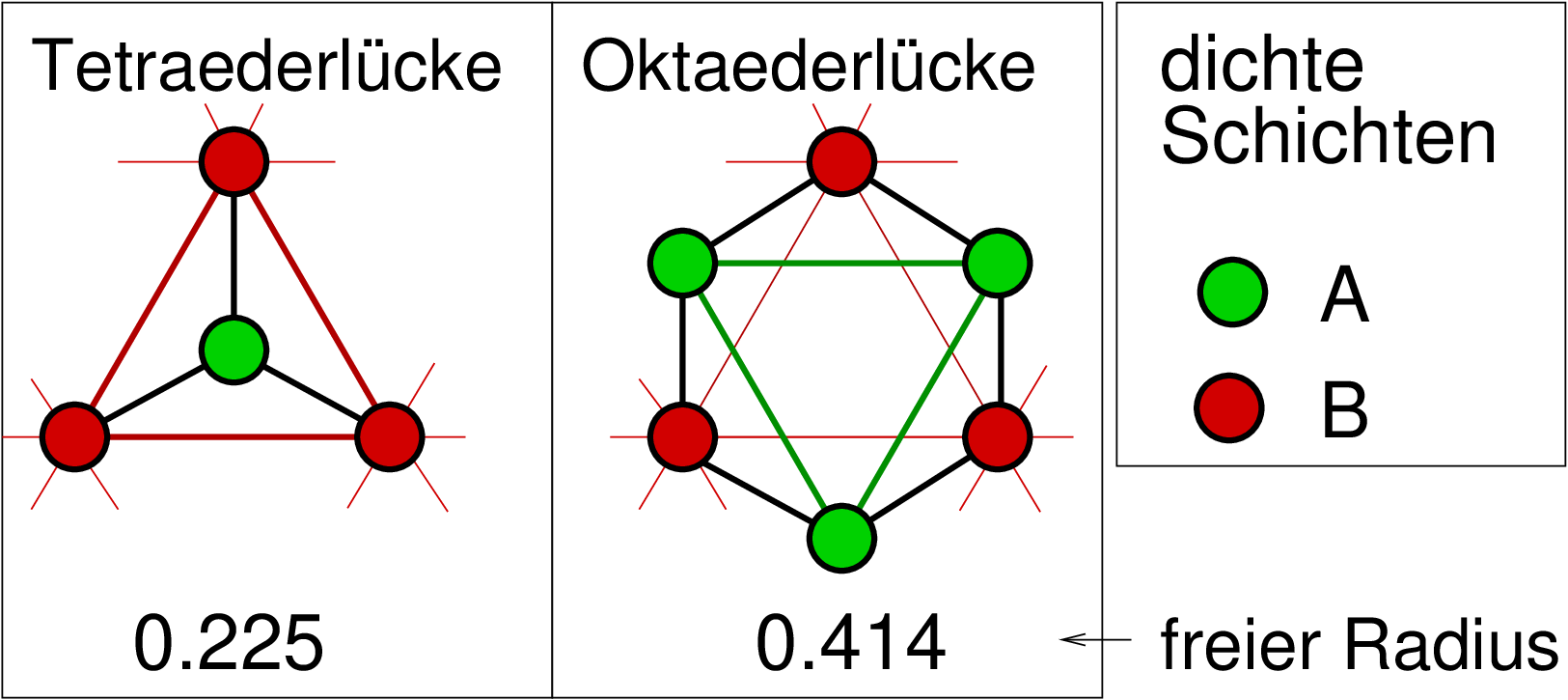 |
| Abb. 2.3.1. Tetraeder (links)
und Oktaederlücke (rechts) zwischen dichtgepackten Schichten A und B
‣SVG
|
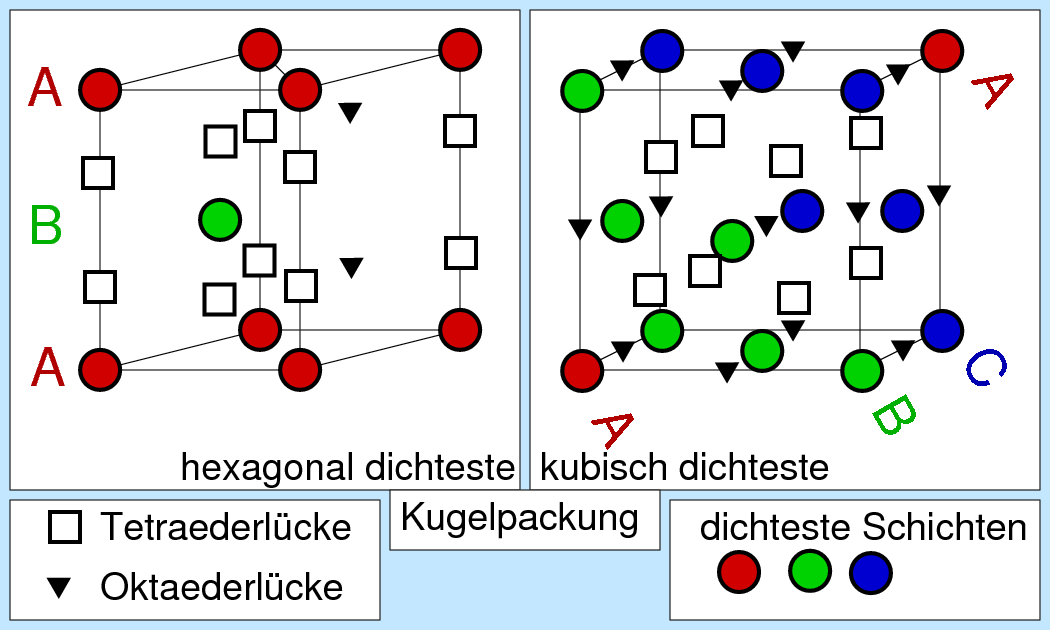
- Die Bestimmung der Zahl der Lücken läßt sich am einfachsten anhand der kubisch dichtesten Kugelpackung
(f.c.c.) zeigen. Die Abbildung 2.3.2. rechts zeigt hierzu diese Packung, in der zusätzlich die Positionen der
beiden Lückenarten eingezeichnet sind. Danach enthält die Elementarzelle
8/8 (Ecken) + 6/2 (Flächen), also 4 Kugeln. In der Zelle liegen 8 Tetraederlücken (Vierecke) und
1 (Zellmitte) + 12/4 (Kantenmitten) = 4 Oktaederlücken (Dreiecke). Auf N Packungsbildner (Anionen) kommen demnach
hier und in allen dichtesten Kugelpackungen N Oktaeder- und 2N Tetraederlücken.
 |
|
Abb. 2.3.2. Positionen
der Lücken in der hexagonalen (links) bzw. der
kubisch (rechts) dichtesten Kugelpackung
‣SVG
|
Bilderserie zu Lücken in dichten Packungen (zwischen 2 dichtesten Schichten A und B)
Zwei der drei wichtigsten MX-Strukturtypen von Ionennkristallen basieren auf der
kubisch dichtesten Kugelpackung der Anionen X:
- Bei etwas kleinere Kationen (Radienverhältnis rKation/rAnion = 0.73-0.41)
passen sechs Anionen um ein Kation (CN 6).
Das Polyeder entspricht einem Oktaeder von Anionen um das Kation.
Daraus resultiert der NaCl-Typ,
der damit also als kubisch dichteste Kugelpackung (f.c.c.) der Cl--Anionen
beschrieben werden kann, in der die Kationen alle Oktaederlücken füllen.
Der NaCl-Typ ist einer der wichtigsten Stukturtypen überhaupt. Beispielsweise bilden auch
fast alle Monooxide der 3d-Übergangsmetallreihe diesen Strukturtyp.
Werden bei einer hexagonal dichten Packung (h.c.p.) alle Oktaederlücken besetzt, so gelangt
man zum
NiAs-Typ. Dieser wird bei echten Salzen nicht beobachtet, da hier
Oktaeder über gemeinsame Flächen verknüpft sind und sich damit
die Kationen in den Zentren dieser Oktaeder schlicht zu nahe kommen.
- Wenn die Kationen sehr klein sind (Radienverhältnis rKation/rAnion < 0.41)
passen nur noch vier Anionen um ein Kation (CN 4).
Geometrisch liegt ein Tetraeder von Anionen um das Kation vor (und umgekehrt).
Bilden die Anionen wiederum eine kubisch dichteste Packung (f.c.c.), dann
sind bei Ionenkristallen AB nach der obigen Berechnung der Lückenzahlen nur
die Hälfte der Tetraederlücken gefüllt. Der
resultierende Strukturtyp ist der ZnS (Zinkblende)-Typ,
der hier bei den Alkalimetall-Halogeniden nicht auftritt, jedoch bei einigen Chalkogeniden der Erdalkalimetalle
wichtig ist (s.o.).
Ein großer Teil der Strukturchemie von Ionenkristallen kann mit diesem Konzept 'gefüllte
Lücken in Anionenpackungen' einfach erklärt und systematisiert werden.
Ausgehend von der hexagonal dichtesten Kugelpackung resultieren z.B. ganz analog wie
oben der NiAs- (gefüllte Oktaederlücken) bzw. der Wurtzit-Typ (zur Hälfte gefüllte Tetraederlücken).
Die vollständige Übersicht dieser Betrachtung von Ionenkristallstrukturen
gibt es in Kapitel 4.3.
der Vorlesung Anorganische Strukturchemie.
An dieser Stelle hierzu noch die im SS 2023 im Verlauf der Vorlesung zusammengestellte
vereinfachte Tabelle:
| Packung der Anionen ↦ |
f.c.c. |
h.c.p. |
| Anteil besetzter Lücken ↧ |
OL (N) |
TL (2N) |
OL (N) |
TL (2N) |
| 100 % (1) |
• NaCl |
• Li2O (anti-CaF2) |
• NiAs |
GEHT NICHT! |
| 75 % (3/4) |
|
• Mg3N2 |
|
|
| 66.7 % (2/3) |
|
|
• Al2O3 (Korund) |
|
| 50 % (1/2) |
• CdCl2 (Schichten) |
• ZnS (Zinkblende) |
• CdI2 (Schichten)
• TiO2 (Rutil)
• CaCl2 (sehr ähnlich Rutil) |
• ZnS (Wurtzit) |
| 33.3 % (1/3) |
• CrCl3 (Schichten)
• VF3 (ähnlich ReO3) |
|
• BiI3 (Schichten) |
|
| 25 % (1/4) |
|
• SiS2 (Ketten)
• HgI2 (Schichten) |
|
|
| 50 % (1/2) OL + 12.5 % (1/8) TL |
• MgAl2O4 (Spinell) |
• Mg2[SiO4] (Olivin) |
Tab. 2.3.3. Vereinfachte Tabelle zu Strukturen von Salzen (aus dem SS 2023)
Einen Überblick über die Kationen-Grössen gibt die Abbildung 2.3.4. mit den
Ionenradien der Kationen nach Shannon (in [pm], Referenz: O2--Ion mit 140 pm).
 |
|
Abb. 2.3.4. Ionenradien der Kationen nach Shannon (nach Oxidationsstufen, in [pm])
‣SVG
|
Und hier noch zwei kleine Videos zu den Lücken in den dichtesten Kugelpackungen.
Nummer 1 zur Art der Lücken ...
| ✍Lücken in dichteste Kugelpackungen I: Art der Lücken (90MB|MP4|H264) |
|
... und das zweite zu der Zahl der Lücken ...
| ✍Lücken in dichteste Kugelpackungen II: Zahl der Lücken
(85MB|MP4|H264) |
|
Die beiden praktisch wichtigsten Alkalimetallhalogenide sind:
- Natriumchlorid, NaCl (Schmelzpunkt: 801oC) kann nach drei verschiedenen
Methoden gewonnen werden:
- Der bergmännische Abbau spielt vor allem für NaCl, das für technische
Zwecke verwendet wird, die wichtigste Rolle.
- Auf dem Weg der sogenannten Aussolung, d.h. des Eindampfens wässriger Kochsalzlösungen,
wird vor allem Speisesalz gewonnen. Ein Vorteil dieses Verfahrens ist die
einfache Variation der Korngrößen.
- Meersalz wird in südlichen Ländern in Salzgärten gewonnen, wobei vom
erheblichen Salzgehalt der Meere (NaCl-Gehalte: Totes Meer: 23%, Ostsee: 0.9%)
ausgenutzt wird.
Umkristallisieren von Kochsalz ist schwierig, da die Löslichkeit kaum temperaturabhängig
ist. Daher wird die Ausfällung z.B. durch Einleiten von HCl-Gas bzw. durch
Zugabe von konzentrierter Salzsäure erreicht, wobei HCl das Wasser bindet
und das Gleichgewicht
Na+ + Cl- ⟶ NaCl
in Richtung NaCl verschiebt.
Kochsalz wird direkt oder indirekt (als Soda) zur Darstellung fast aller
Natrium-Verbindungen wie z.B. NaOH, Borax, Wasserglas usw. verwendet.
Eis/Kochsalz-Mischungen sind bis -21oC wegen der Gefrierpunktserniedrigung
noch flüssig ('Salzen' von Strassen usw.). Einen Überblick
über Gewinnung, Weiterverarbeitung und Verwendung von NaCl gibt die Abbildung 2.3.5.
 |
| Abb. 2.3.5. Gewinnung
und Weiterverarbeitung von NaCl
‣SVG
|
- Kaliumchlorid, KCl (Sylvin) wird durch bergmännischen Abbau
gewonnen und - entsprechend NaCl - zur Darstellung vieler Kalium-Verbindungen
eingesetzt. Neben dem direkten Einsatz als Düngemittel ist hier wichtig, dass
viele K-Salze, im Unterschied zu den Na-Salzen, ohne Kristallwasser kristallisieren
und damit auch weniger hygroskopisch sind. Dies ist z. B. wichtig für den
Einsatz entsprechender Salze als Spreng- und Explosiv-Stoffe.















