Vorlesung Strukturchemie der Oxide
3. Binäre Metalloxide
Vor allem bei den Sauerstoffverbindungen der Alkali- und Erdalkalimetalle gibt es
zusätzlich zu den Oxiden mit isolierten O2--Anionen
auch Oxide mit komplexen Anionen. Hierzu zählen die
- Peroxide mit O22--Ionen
- Hyperoxide (Superoxide), mit O2--Ionen
- Sesquioxide, mit O22-- neben O2--Ionen
- Ozonide mit Ozonid-Ion O3-
Bei allen Verbindungen steigt die Stabilität mit dem elektropositivem Charakter
des Kations, so daß Verbindungen dieser Art
generell nur von den elektropositiven Alkali- und Erdalkalimetallen
sowie einigen unedlen Übergangsmetallen bekannt sind.
Bereits bei der einfachen Verbrennung der Alkalimetalle mit Sauerstoff
(an Luft entstehen auch Nitride!) zeigt sich die Vielfalt möglicher Oxide:
- Li: verbrennt zu Li2O und etwas Li2O2
- Na: bildet Na2O2 und etwas Na2O
- K, Rb und Cs verbrennen zu MO2,
aber
unter anderen Bedingungen lassen sich von allen drei schweren Alkalimetallen
die Verbindungen M2O, M2O2 und MO2 und
z.T. auch MO3 darstellen.
Die normalen Oxide (mit isolierten O2--Anionen) der Alkalimetalle
kristallisieren - mit Ausnahme des orange-roten Cs2O, das als einzigen Oxid den
anti-CdCl2-Typ bildet - im anti-CaF2-Typ.
Die Peroxide enthalten das Ion O22-
mit einem einer O-O-Einfachbindung entsprechenden Abstand von 149 pm
(Isosterie zu den Halogenen).
Sie sind als Salze der zweibasigen Säure H2O2
aufzufassen und reagieren entsprechend mit Wasser zu Wasserstoffperoxid.
Die einzelnen Verbindungen nach Zusammensetzung bzw. Oxidationsstufe des
Metall-Kations M:
MI: Die Alkalimetallperoxide der Zusammensetzung
M2O2 sind von allen Alkalimetallen bekannt.
Es handelt sich um weiße bis gelbe Feststoffe, die mit der Ausnahme von
Li2O2 bis zu hohen Temperaturen stabil sind.
Sie lassen sich auf unterschiedliche Weise herstellen:
- Li2O2 läßt sich aus LiOH und
H2O2 herstellen.
- Na2O2 entsteht bei der einfachen Verbrennung von Natrium
- Die Peroxide der schwerere Alkalimetalle lassen sich durch Oxidation der Metalle in
flüssigem Ammoniak gewinnen.
Na2O2 findet vielfach als Bleichmittel Verwendung.
Die Na- und die Li-Verbindunge können in Atemgeräten eingesetzt werden,
da sie nach
Na2O2 + CO --> Na2CO3
bzw.
Na2O2 + CO2 --> Na2CO3 + 1/2 O2
sowohl CO binden, als auch mit CO2 Sauerstoff entwickeln.
Die Strukturvielfalt in dieser Gruppe ist relativ groß und soll an dieser
Stelle nicht weiter vertieft werden.
MII Die Peroxide der 2-wertigen Metalle (Formel:
MO2)
sind von allen Erdalkalimetallen sowie von Zn und Cd bekannt.
Die Darstellung ist wiederum bei den schweren Erdalkalimetallen einfacher.
Die Ca-Verbindung kann durch Entwässern von CaO2 . 8
H2O, jedoch nicht direkt aus den Elementen hergestellt werden.
SrO2 entsteht dagegen direkt bei Anwendung eines erhöhten
O2-Partialdrucks.
Ba-Peroxide entsteht bei der einfachen Oxidation des Elementes bei 500 oC.
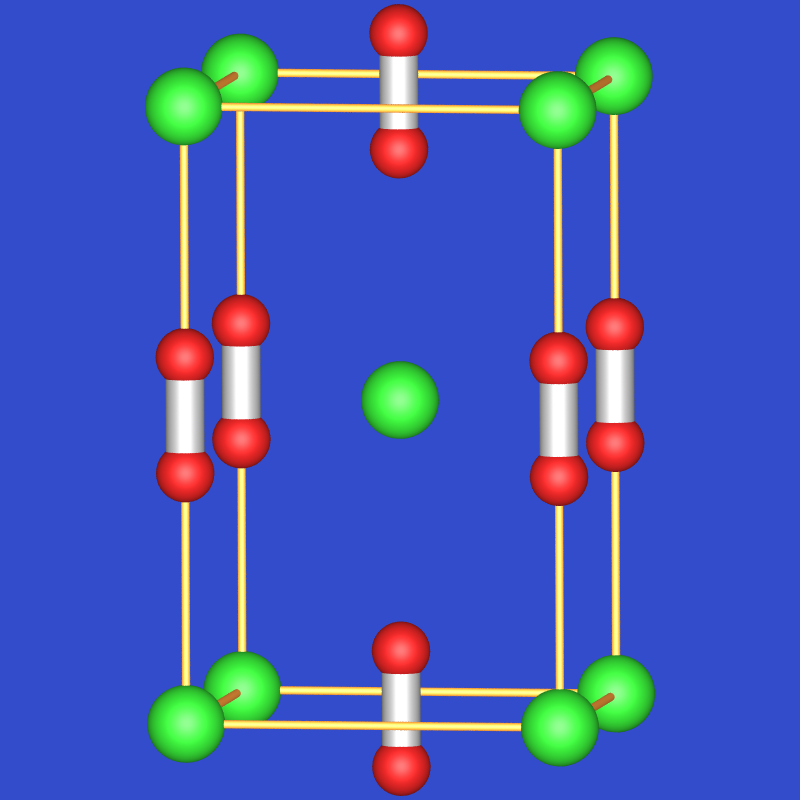
Bei den Strukturen beobachtet man abhängig vom Ionenradius von M das
Auftreten zweier Strukturtypen:
- CaO2, SrO2 und BaO2
mit den größeren M-Kationen kristallisieren im
CaC2-Typ .
Ausgehend vom
NaCl-Typ
sind die C2-Ionen entlang einer der
kubischen Achsen ausgericht, so daß letztlich tetragonale Symmetrie
resultiert (mit c > a = b). Die Koordinationszahlen betragen für M=10 und
für O=4.
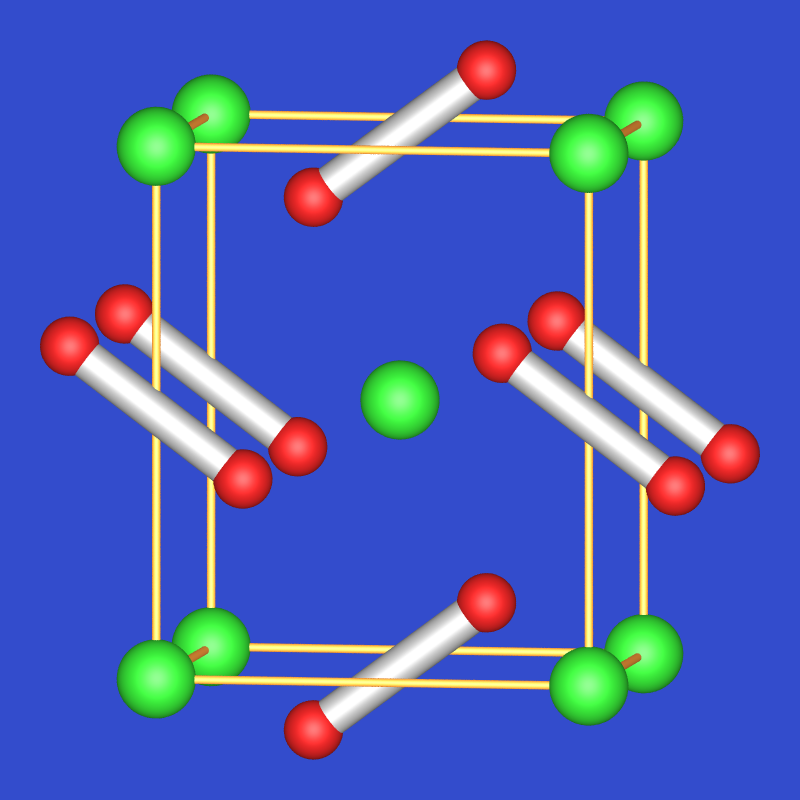
- MgO2, ZnO2 und CdO2, die Verbindungen mit den kleineren
M-Kationen, bilden den
Pyrit-(FeS2)-Typ . Dieser läßt sich
ebenfalls ausgehend vom
NaCl-Typ ableiten, indem die S2-Ionen auf
den Cl-Plätzen entlang (111) ausgerichtet sind.
(Die Metrik der Elementarzelle bleibt dabei zwar kubisch, die Symmetrie
erniedrigt sich aber von Fm3m auf Pa3). Die Koordinationszahl von M (Fe)
beträgt sechs, die von Sauerstoff (S) drei.
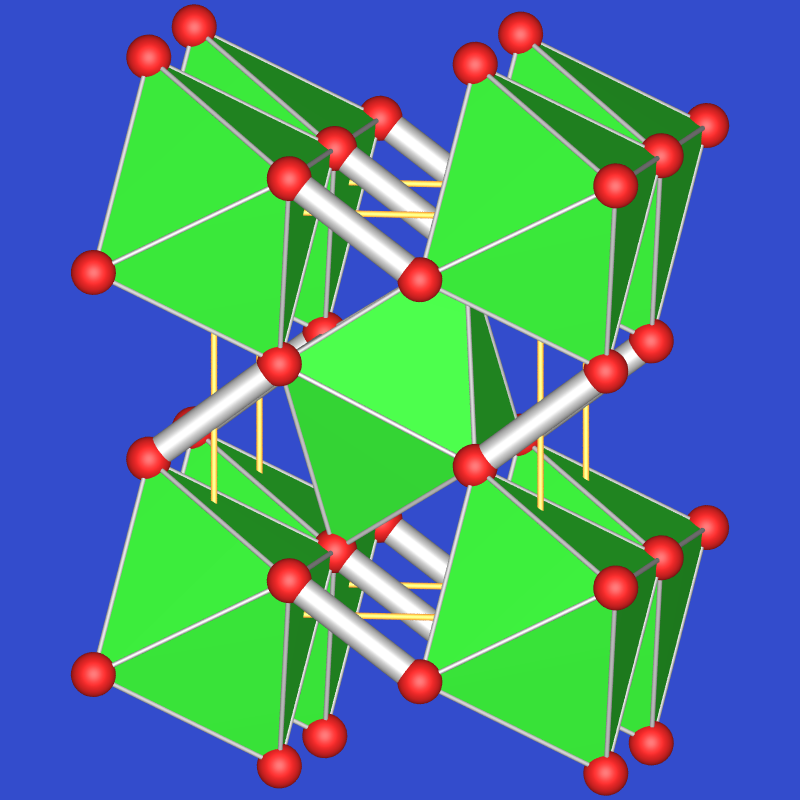
Übersicht: AB2-Verbindungen mit B2-Hanteln (Peroxide, Hyperoxide)
| Strukturtyp |
NaCl (fehlgeordnet) |
CaC2 |
Pyrit (FeS2) |
Markasit (FeS2) |
| |
 |
 |
 |
| |
 |
| Peroxide MIIO2 |
- |
CaO2, SrO2 , BaO2 |
MgO2, ZnO2 , CdO2 |
- |
| Hyperoxide MIO2 |
alle HT-Formen |
KO2, RbO2 , CsO2 |
beta-NaO2 |
alpha-NaO2 |
| CN (M) |
- |
10 |
6 |
6 |
| CN (O) |
- |
4 |
3 |
3 |
| Metrik, RG |
kubisch, Fm3m |
tetragonal |
kubisch Pa3 |
orthorhombisch |
Die Superoxide (auch Hyperoxide) enthalten das paramagnetische
Ion O2- mit einem ungepaartem Elektron.
Der O-O-Abstand entspricht mit 128 pm einer Bindungsordnung von 1.5 und
ist damit z.B. vergleichbar mit dem im Ozon. Der
Sauerstoff-Sauerstoff-Abstand im Element O2 beträgt dagegen 121 pm.
MI: Alkalimetallsuperoxide MO2 sind von allen
Alkalimetallen außer Lithium bekannt.
NaO2 läßt sich aus den Elementen nur unter Druck rein
darstellen, während die der schwereren Metalle bei der Oxidation der
Metalle direkt gebildet werden.
| Verbindung |
Farbe |
Modifikation |
T-Bereich |
Struktur |
GIF |
| NaO2 |
weiss |
alpha |
< -77 oC |
Markasit (FeS2) |
 |
| beta |
-77 bis -50 oC |
Pyrite (FeS2 |
 |
| gamma |
> -50 oC |
NaCl (fehlgeordnete O2) |
|
| KO2 |
orange |
für alle drei schwereren Alkalimetalle |
RT |
CaC2-Typ |
 |
| RbO2 |
braun |
| CsO2 |
orange |
HT |
NaCl (fehlgeordnete O2) |
MII Hyperoxide M(O2)2
sind von Ca, Sr und Ba bekannt, aber sehr instabil.
Die Strukturen der gelben Festkörper sind unbekannt.
Sesquioxide enthalten die Anionen der Peroxide und Hyperoxide
nebeneinander (O22- und
O2-).
MI
Die Verbindungen der Zusammensetzung M4O6
entsprechend
MI4(O2-)2(O22-)
sind nur für M = Rb und Cs bekannt. Die schwarzen paramagnetischen Substanzen
kristallisieren in der kubischen anti-Th3P4-Struktur.
Da die Positionen der Ionen O2- und
O22- symmetrieäquivalent sind, sind sie im Kristall
nicht unterscheidbar.
Ozonide enthalten das Ozonid-Ion O3-.
MI-Ozonide MO3 sind nur für die schwereren
Alkalimetalle K, Rb und Cs bekannt. Die Verbindungen bilden rote Kristalle,
die sich aus O3 und dem Hydroxid herstellen lassen.
Die MII-Ozonide M2(O3)2 sind
nur bei tiefen Temperaturen stabil.










