Vorlesung Chemie der Metalle
9. Übergangsmetalle II
VIII. Nebengruppe/8. Gruppe/Fe/Co/Ni-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel: (im Aufbau, bisher nur Materialien)
Allgemeines
Die 3d-Elemente der VIII. Nebengruppe (8., 9. und 10. Gruppe)
sind die extrem wichtigen Gebrauchsmetalle
Eisen, Cobalt und Nickel. Eisen ist mit einer Häufigkeit von 4.7 % in der
das vierhäufigste Element der Erdkruste.
Die Chemie der neu Element ist sehr vielfältig. Die
Tabelle 9.8.1. gibt einen Überblick über die wichtigsten Oxidationsstufen
und die generellen Trends ihrer Stabilitäten (rot: wichtigste OS, orange: weniger wichtig;
gelb: selten). Zusätzlich gibt es von allen Elementen Carbonyl-Komplexe,
in denen das Metall als Atom vorliegt (Oxidationsstufe 0).
| Trends |
⟶ maximale OS abnehmend ⟶ |
|
|
v
maxi-
male
OS
zu-
nehmend
|
|
V
|
| 3d |
Fe |
Co |
Ni |
| +I |
|
d8 |
|
| +II |
d6 |
d7 |
d8 |
| +III |
d5 |
d6 |
|
| +IV |
d4 |
d5 |
|
| +V |
d3 |
d4 |
|
| +VI |
d2 |
|
|
|
| 4d |
Ru |
Rh |
Pd |
| +I |
d7 |
d8 |
|
| +II |
d6 |
d7 |
d8 |
| +III |
d5 |
d6 |
|
| +IV |
d4 |
d5 |
d6 |
| +V |
d3 |
|
|
| +VI |
d2 |
d3 |
|
| +VII |
d1 |
|
|
| +VIII |
d0 |
|
|
|
| 5d |
Os |
Ir |
Pt |
| +I |
|
|
|
| +II |
d6 |
|
d8 |
| +III |
d5 |
d6 |
|
| +IV |
d4 |
d5 |
d6 |
| +V |
d3 |
d4 |
d5 |
| +VI |
d2 |
d3 |
d4 |
| +VII |
d1 |
|
|
| +VIII |
d0 |
|
|
| Tab. 9.8.1. Ausschnitt aus
der Übersicht der Oxidationsstufen: Fe- und Pt-Gruppe |
Eisen
Vorkommen, Gewinnung, Eigenschaften
Eisen kommt (ausser im Erdkern) nur selten gediegen vor (Fe-Meteorite).
Die praktisch wichtigsten Eisenerze sind Oxide wie
Magneteisenstein Fe3O4 (Magnetit),
Roteisenstein Fe2O3 (Hämatit, Glaskopf)
oder Brauneisenstein (Hauptanteil: Goethit, FeOOH).
Daneben kennt man vom zweiwertigen Eisen das einfache
Carbonat, Spateisenstein oder Siderit FeCO3,
das wasserhaltige Phosphat Vivianit (Blaueisenerde,
Fe3[PO4]2. 8 H2O)
und zahlreiche Silicate (z. B. Fayalit, Fe2[SiO4]).
Die wichtigsten Sulfide sind Eisenkies (FeS) und Pyrit (FeS2), beide
enthalten ebenfalls Fe(II) (s. Fotos Abb. 9.8.1). XX Vivianit + neue
Magnetite XX
 |
 |
 |
| Magneteisenstein |
Roteisenstein |
Rötel |
 |
 |
 |
| Hämatit (Oberwolfach) |
Magnetit-Kristalle |
Pyrite (Spanien) |
| Abb. 9.8.1. Einige Eisen-Minerale |
Im Labor kann Eisen durch Reduktion mit Wasserstoff gewonnen werden:
Fe2O3 + H2 ⟶ 400-700oC ⟶ Fe + H2O
Die technische Herstellung wurde früher (bis ca. 1600) in sogenannten Rennöfen
durchgeführt:
Kohle + Erz ⟶ Schlacke (läuft ab) + Luppe (bleibt übrig)
s. G. Agricola, 1556, deutsche Übersetzung
Abbildung S. 365
Die Herstellung von Stahl erfolgt heute in zwei einzelnen Schritten:
- Erzeugung von Roheisen
Roheisen enthält ca. 4 % Kohlenstoff gelöst, ist spröde und nicht schmiedbar.
Zur Herstellung von Roheisen werden als Rohstoffe Roteisenstein
(Fe2O3, Eisengehalt ca. 40-65 %)
oder Magneteisenstein (Magnetit, Fe3O4, 45-70% Fe) (s. Abb. 9.8.1.)
und außerdem Kohle oder Koks und Zuschläge wie Kalk und diverse Silicate
in einen Hochofen eingeschichtet.
Zusätzlich wird sogenannter Wind,
vorgewärmte, mit O2 angereicherte Luft von 1300oC und 4 bar benötigt.
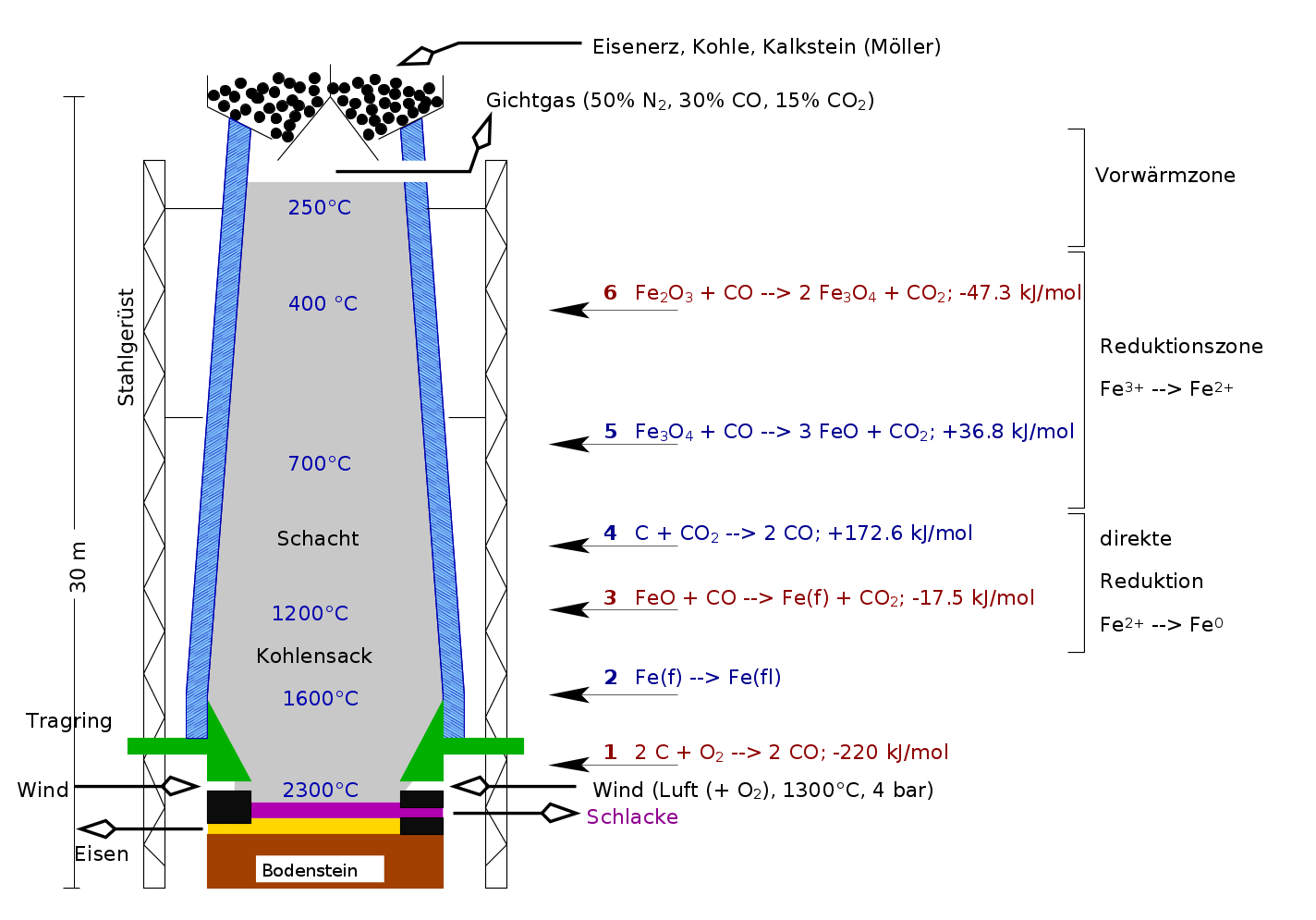 |
| Abb. 9.8.2.
Skizze zur Herstellung von Roheisen im Hochofen
‣SVG
|
Der Hochofen selber (s. Abb. 9.8.2.) ist ca. 40 m hoch und unten ca. 15 m breit.
Die Neigung ist der Volumenänderung der Füllung angepaßt.
In den Hochofen werden abwechselnd Koks und Erz gefüllt, dazu kommen die
Kalkzuschläge, die zu einer Verschlackung (Bildung von leicht schmelzenden Ca-Silicaten/Aluminaten)
der Si- und Al-Bestandteile führen.
Für den Betrieb: (Schritte von unten nach oben):
- Anzünden der untersten C-Schicht:
2 C + O2 ⟶ 2 CO (-222 kJ)
Diese Reaktion ist exotherm, verantwortlich für die
hohe Temperatur im ganzen Hochofen und treibt die insgesamt endotherme
Reduktion der Eisenoxide.
Bei den Folge-Schritten 2. und 3. wird dadurch die insgesamt stark endotherme direkte
Reduktion von Fe2+ zu Fe0 erreicht:
2 FeO + C ⟶ 2 Fe + CO2 (+138.2 kJ)
Dabei wirkt (s. Schritt 2) letztlich CO als Reduktionsmittel, das durch
die Einstellung des Boudouard-Gleichgewichtes immer wieder nachgebildet wird (s. Schritt 3).
- CO steigt in die Erzschicht und wirkt als Reduktionsmittel. Dabei entsteht CO2.
FeO + CO ⟶ Fe + CO2 (-17.5 kJ/mol)
Dieser Reduktionsschritt ist schwach exotherm.
- In der nächsten Koksschicht stellt sich wieder das Boudouard-Gleichgewicht ein:
CO2 + C ⟶ 2 CO (+172.6 kJ/mol)
das, da es sich um eine endotherme Reaktion handelt, bei hohen Temperaturen (ca. > 800 oC) auf der rechten Seite liegt.
- In der Reduktionszone erfolgt bei ca. 600oC die Reduktion von
Fe3+ zu Fe2+.
Fe2O3 + CO ⟶ Fe3O4 + CO2 (-47.3 kJ)
Fe3O4 + CO ⟶ 3 FeO + CO2 (+36.8 kJ)
Ganz oben im Hochofen, d.h. bei niedrigen Temperaturen, erfolgt diese Reduktion von Fe3+ zu
Fe2+ mit dem letzten CO.
Das Boudouard-Gleichgewicht (s.o.) liegt her bereits links, CO2 reagiert
nicht mehr mit dem Koks zu CO weiter.
Die Produkte des Hochofenprozesses sind insgesamt:
- Roheisen mit einem C-Gehalt von ca. 2-4 %
- sogenannte Gicht mit der Zusammensetzung: 50 % N2, 30 % CO und 15 % CO2, die
wegen ihres noch erheblichen Brennwertes zum Anheizen des Windes verwendet wird.
- Schlacke, Ca-Silicate/Aluminate, die im Straßenbau verwendet werden kann.
- Stahlgewinnung
Als Stahl bezeichnet man durch Abschrecken härtbares Eisen.
Dazu ist die Verringerung des C-Anteils, die sogenannte Entkohlung von Roheisen
(auch Frischen genannt) erforderlich. Das Phasendiagramm Fe-C (s. Abb. 9.8.3.)
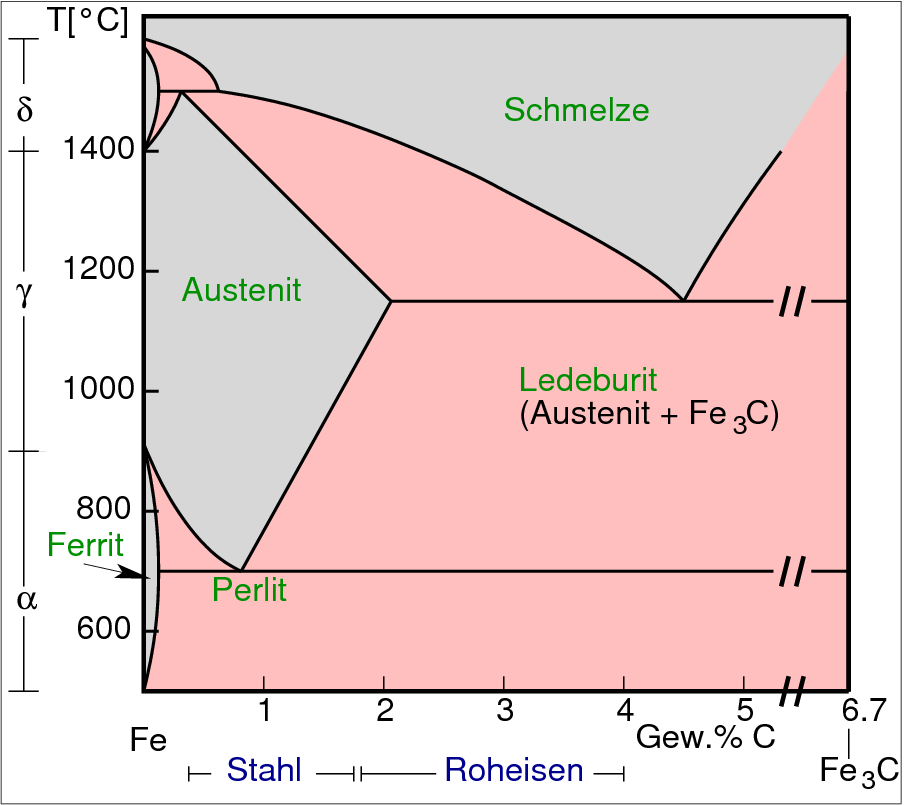 |
| Abb. 9.8.3.
Phasendiagramm Fe-C
‣SVG
|
zeigt die einzelnen Bereiche für Stähle nach Kohlenstoff-Gehalt:
- Roheisen: 2.5-4 % C
- Stahl im engeren Sinn: 0.4 - 1.7 % C.
Stahl ist härtbar durch Erhitzen auf 800 oC und
anschließendes Abschrecken:
Bei 800o C entsteht zunächst, wie das Phasendiagramm
zeigt, sogenannter Austenit, γ-Eisen mit gelöstem Kohlenstoff.
Beim Abschrecken wird metastabiler Martensit (α-Fe, in dem Kohlenstoff
gelöst ist) gebildet. Die Umwandlung der
f.c.c.-Packung (z.B. von γ-Fe) in die b.c.c.-Struktur
(z.B. von α-Fe) wird daher ganz allgemein als Martensitische
Phasenumwandlung bezeichnet.
33 % aller produzierten Stähle sind nichtrostende V2A-Stähle,
(Abb. 9.8.4. links: Bezeichnung V2A/X5CrNi18-10 bzw. 1.4301).
- Baustahl (auch Schmiedeeisen) enthält weniger als 0.4 % C Kohlenstoff.
(Abb. 9.8.4. rechts: Bezeichungen: RSt37-2 (alt) bzw. S235JR (neu))
 |
 |
| V2A-Stahl-Platte (V2A/X5CrNi18-10 bzw. 1.4301) |
Platte aus Baustahl (RSt37-2 bzw. S235JR) |
| Abb. 9.8.4. V2AStahl und Baustahl |
- Eine ausführliche Beschreibung metallischer Werkstoffe, inkl. Stahl, gibt
es aus der Vorlesung Intermetallische Phasen, Kap. 10: Metalle und Legierungen als Materialien.
Die Entkohlung kann technisch nach zwei Verfahren durchgeführt werden:
- Beim Windfrischen wird das Roh-Eisen zuerst vollständig entkohlt durch
- Einpressen von Luft (Thomas-Verfahren).
- Aufblasen von O2 (Linz-Donauwitzer- kurz LD-Verfahren), das heute das
Hauptverfahren ist.
Die Entkohlung wird in kippbaren Apparaten
(Konvertern, s. auch bei der Cu-Gewinnung) mit
- basisches Futter (CaO) (Thomas-Birne) (bei P-haltigen Erzen)
P2O5 ⟶ Ca3(PO4)2
(Das entstehende Calciumphosphat wird als Dünger verwendet (Thomas-Mehl).)
- saures Futter (Bessemer-Birne)
(Futter: Quarz/Ton, heute nur noch selten verwendet)
durchgeführt. Die Oxidation wird in ca. 15 min durchgeführt, anschließend
wird der Konverter auf die Breitseite gekippt um die Schlacke abzugiessen.
Zur Rückkohlung wird Spiegeleisen oder Ferromangan zugegeben.
- Beim Herdfrischen wird das
Roh-Eisen gleich bis zum richtigen Kohlenstoff-Gehalt entkohlt.
Früher wurden dazu Siemens-Martin-Öfen
verwendet. Heute wird Schrott (Eisenoxid)
im Lichtbogenofen (Elektrostahlwerk, Gleich- oder Wechselstrom)
mit dem Roheisen verschmolzen. Eisenoxid (Rost/Schrott) reagiert mit dem
Restkohlenstoff des Roheisens gemäß:
Fe2O3 + 3 C ⟶ 2 Fe + 3 CO
Die folgende (historische) Zusammenfassung (Abb. 9.8.5.) zeigt nochmals die wichtigsten Prozesse bei der Stahlgewinnung.
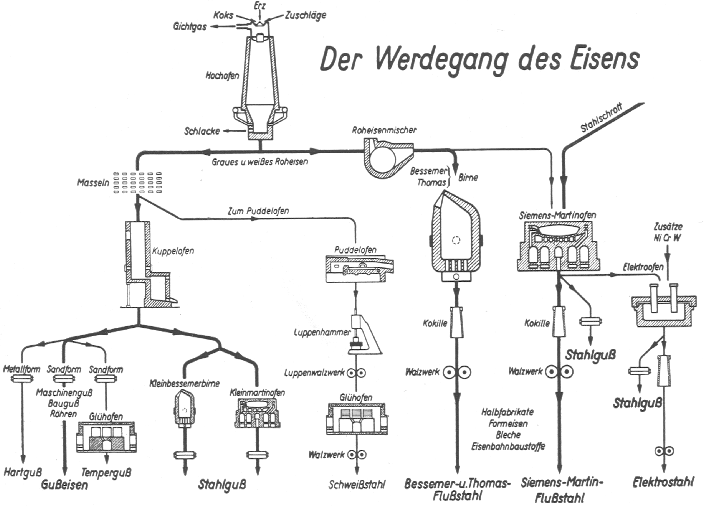 |
| Abb. 9.8.5.
Gewinnung von Stahl (historisch und schematisch;
Anmerkung: Die links aufgeführten Verfahren (z.B. 'Masseln')
sind heute nicht mehr im Gebrauch. Im Puddelofen wurde
Roheisen im halbfesten Zustand entkohlt. |
Links und Literatur zur Eisen- und Stahl-Herstellung
Oxidationsstufen von Eisen: Übersicht
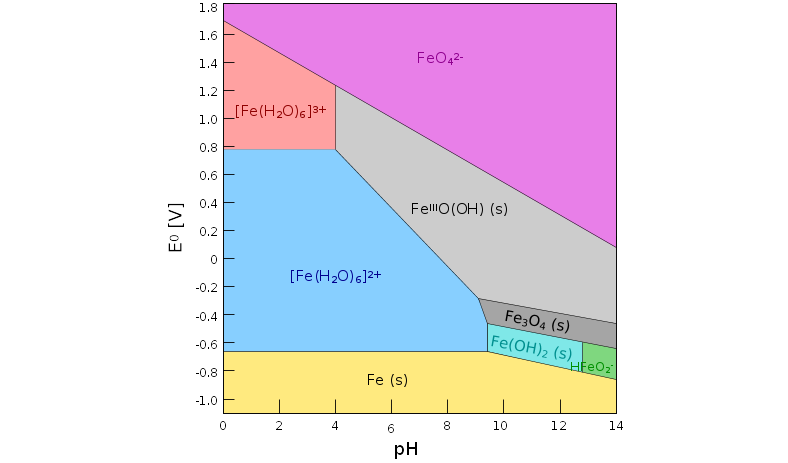 |
| 9.8.6. Pourbaix-Diagramm von Eisen
‣SVG |
Fe(II)
d6-Ion, Salze sehr "ahnlich den Mg-Salzen, in vielen Silicaten z.B. entsprechend
vergesellschaftet mit Mg.
Fe(III)
In Anwesenheit von Sauerstoff und/oder Wasser ist +III die häufigste Oxidationsstufe
von Eisen. In Salzen und Komplexen liegt das d5-Ion i.A. in
der high-spin Konfiguration vor (maximale Spinmultiplitzität).
Eine wichtige Ausnahme davon ist der Komplex mit den (sehr starken) Cyanido-Liganden, z.B. im
'Roten Blutlaugensalz', K3[Fe(CN)6].
Die Chemie von Fe3+ ist der von Al3+ extrem vergleichbar,
praktisch alle Salze sind isotyp. Die
Abtrennung der beiden sehr häufigen Metalle voneinander basiert auf
der Amphoterie von Aluminium, die bei Fe(III) fehlt (s. Al-Gewinnung in Kap. 4.2.)
oder der Möglichkeit der Reduktion zu Fe(II)
(Abtrennung als Fe-Silicate ('Schlacke') oder als 'Grünsalz' bei technischen Trennverfahren).
Fe(III)-Oxide/Hydroxide sind die mit sehr grossem Abstand am häufigsten eingesetzten Gelb- (Goethit)
und Rot-Pigmente (α-Fe2O3),
einige Beispiele sind in Abbildung 9.8.7. zu sehen.
(Zu den Strukturen der Reinstoffe s. bei den Al-Oxide/Hydroxiden in Kapitel 4.4.)
 |
 |
 |
 |
 |
| FeOOH (Diaspor-Struktur) |
α-Fe2O3 (Korund-Struktur) |
Fe3O4 (Spinell-Struktur) |
| (Goethit) |
Bayferrox 110 |
Bayferrox 130 |
Bayferrox 180 |
(Eisenschwarz) |
| Abb. 9.8.7. Fotos einiger Fe-Pigmente |
Das gemischtvalente 'Eisenschwarz' Fe3O4 ist nach reinem Kohlenstoff,
der z.B. nicht in Keramiken oder bei Betonen etc. verwendet werden kann, das zweitwichtigste Schwarzpigment.
Fe3O4 ist wegen seines Ferrimagnetismus zusätzlich auch
ein Magnetpigment.
Fe(VI)
Die maximale Oxidationsstufe von Eisen ist +6 (d2), die z.B.
im Orthotetraoxidoferrat(VI)-Ion [FeO4]2- vorliegt. Dieses
violette Ion ist nur im stark Basischen (also mit den unprotonierten 'harten' Oxido-Liganden)
stabil (s. Versuch und Pourbaix in Abb. 9.8.XX). Die Farbe basiert wie beim Permanganat
oder bei den Chromaten auf einem LM-CT-Prozess.
| ⚗ Herstellung von Fe(VI)
(38MB|MP4|H264) |
|
|
Die Herstellung des Tetraoxido-Ferrat(VI)-Ions [FeO4]2-
gelingt mit Hilfe von elementarem Chlor, das 'in-situ' aus Chlorid und Chlorit
freigesetzt wird. Das violette Ion ist nur im Basischen stabil (s. Pourbaix-Diagramm),
im Sauren erfolgt sofortige Reduktion zu Fe(III)-Hydroxid.
|
Cobalt
Element
Elementares Cobalt (Abb. 9.8.XX) kristallisiert in der hexagonal-dichten Kugelpackung.
 |
| Abb. 9.8.XXX: Elementares Cobalt |
Co(II)
Rinmanns Grün ist Zinkoxid (ZnO), das durch den Einbau geringer Mengen von Co(II)-Ionen
grün wird. Nimmt man bei der Herstellung zu grosse Mengen von Cobalt, so
entsteht der Co-Spinell Co3O4, der Co(II) und Co(III) nebeneinander enthält.
| ⚗ Herstellung von Rinnmanns Grün
(44MB|MP4|H264) |
|
|
Erfolgreiche (und nicht erfolgreiche) Herstellung von Rinmanns Grün, ein Co(II)-'dotiertes' ZnO.
Das schwarze Produkt, das man erhält wenn man mit zu hohen Co-Konzentrationen
arbeitet, ist ein Spinell mit Co(III)-Ionen, entweder direkt Co3O4
oder auch ZnCo2O4.
|
Auch im Thenards-Blau CoAl2O4 (s. im Kapitel 4.4. beim Al und bei den Spinellen)
liegt Co(II) in tetraedrischer Koordination vor. Die Farben entstehen jeweils
durch d-d-Übergänge im tetraedrischen Ligandenfeld
(s. dazu auch den Versuch 'Geheimtinte' bei der Komplexchemie im Kapitel 8.3.).
'Smalte' (s. Abb. 9.8.XX) ist ein Glas, das mit Co(II)-Ionen gefärbt ist;
fein gemahlene Smalte wurde im Mittelalter als Blaupigment eingesetzt.
Auch das aus dem Labor bekannte 'Co-Glas'
ist analog zusammengesetzt. Die Vorprobe auf Cobalt mit der Borax- oder Phosphorsalzperle
beruht auf dem gleichen Prinzip.
 |
 |
| Smalte |
CoAl2O4 (Thenard-Blau) |
| 9.8.XX. Einige Co(II)-Pigmente |
Co(III)
Von Cobalt in der Oxidationsstufe +III (d6) gibt es eine grosse Zahl klassische 'Werner'-Komplexe.
Obwohl Cobalt als 3d-Metalle keine starke Auspaltung der d-Zustände bewirkt, liegt auch
mit schwache Liganden fast immer die oktaedrische LS-Konfiguration, und somit diamagnetische Komplexe, vor.
Fotos einiger Kompelxe aus unserer Sammlung folgen HIER
Legierungen
Sehr wichtige Co-reiche Legierungen, die als Permanentmagnete verwendet werden,
sind SmCo5 und Sm2Co7, die
beim Samarium, d.h. bei den Lanthanoiden in Kapitel 7.1., besprochen wurden.
Nickel
Element
Elementares Nickel (Abb. 9.8.XX) kristallisiert in der kubisch-dichtesten Kugelpackung.
 |
| Abb. 9.8.XXX: Elementares Nickel |
Ni(II)
Bei Nickel dominiert die Zweiwertigkeit die Chemie in wässrigen Systemen.
Das d8-Ion ist dabei meistens oktaedrisch, seltener und nur mit Liganden die
diese Geometrie vorgeben (der Klassiker: DADO) quadratisch planar koordiniert.
Auch tetraedrische Komplexe sind bekannt, vor allem mit grösseren Liganden.
Weitere Oxidationsstufen
Man kennt auch Ni(III)-Verbindungen wie z.B. NiO(OH).
Mit 'harten' Liganden wie Oxid oder Fluorid gibt es schliesslich d6-Systeme
mit meist oktaedrische koordiniertem Ni(IV), wie z.B. NiO2 (s. Li-Ionen-Akku)
oder K2[NiF6].
Ruthenium und Osmium
-- keine Versuche ohne Studiengebühren --
Rhodium und Iridium
-- keine Versuche ohne Studiengebühren --
Palladium und Platin
-- keine Versuche ohne Studiengebühren --
... aber immerhin aus dem F-Praktikum ...
 |
| 9.8.XX Pt-Tiegel |


























