Vorlesung Chemie der Nichtmetalle
1. Einleitung
1.2. Chemische Bindung in Nichtmetallen und ihren Verbindungen
|
Für die Art der chemischen Bindung ist immer wichtig:
- die Summe der Elektronegativitäten ΣEN
- die Differenz der Elektronegativitäten ΔEN
der an der Bindung beteiligten Partner.
Je nach dem Wert dieser beiden Größen unterscheidet man bekanntlich:
- Bei großer Differenz der Elektronegativitäten ΔEN
werden Salze gebildet, d.h. es werden zunächst Ionen gebildet,
die durch Coulomb-Wechselwirkungen zu typischen Ionenkristallen
zusammentreten (z.B. NaCl, CaO oder Al2O3)
- Bei großer Summe der Elektonegativitäten (ΣEN) aber kleiner
Differenz (ΔEN) tritt kovalente Bindung auf, es entstehen typische
Molekülverbindungen (z.B. CO2, Cl2, HCN) oder kovalente
Feststoffe (Diamant, Selen).
- Bei kleiner Summe und kleiner Differenz der Elektronegativitäten
entstehen Metalle oder metallische Legierungen (z.B. Cu, Messing (Cu-Zn)).
Das folgende Dreieck (das sogenannte Ketelaar-Dreieck) gibt am Beispiel von Verbindung aus der 3. Periode
die Übergänge der einzelnen Bindungsarten anhand existierender Verbindungen anschaulich wieder:
| |
NaCl |
|
| |
MgCl2 |
|
Na2S |
|
| |
AlCl3 |
|
MgS |
|
NaP |
|
| |
SiCl4 |
|
Al2S3 |
|
MgP |
|
NaSi |
|
| |
PCl3 |
|
SiS2 |
|
AlP |
|
Mg2Si |
|
NaAl |
|
| |
SCl2 |
|
P4S6 |
|
- |
|
- |
|
MgAl2 |
|
NaMg |
|
| Cl2 |
|
S8 |
|
P4 |
|
Si |
|
Al |
|
Mg |
|
Na |
Oder als echtes Dreieck:
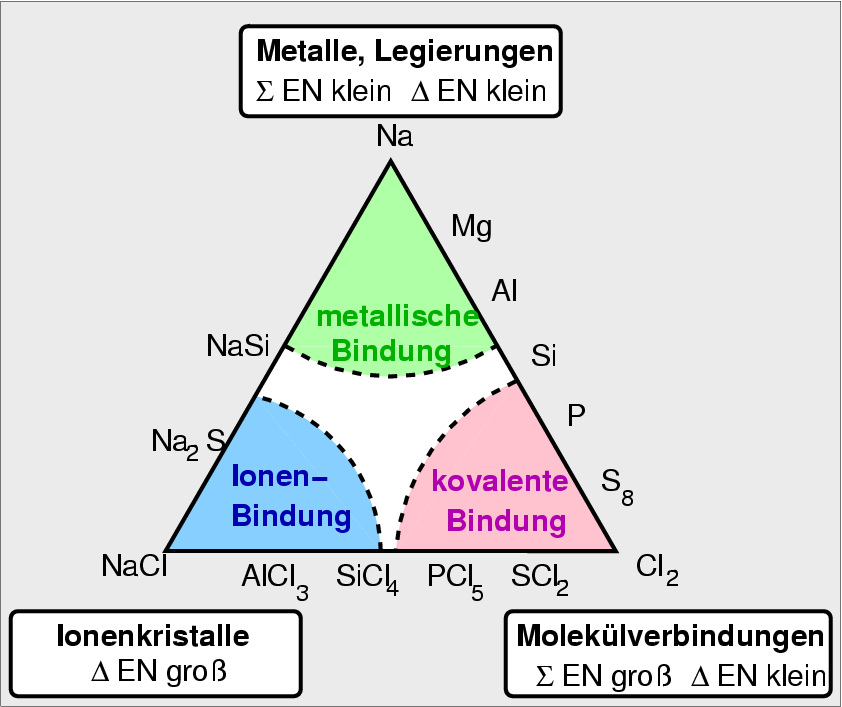 |
| Abb. 1.2.1. Bindungstypen in Verbindungen der 3. Periode
‣SVG
|
Bei den metallischen Elementen (vgl. Vorlesung Chemie der Metalle)
hat man es also je nach Differenz der EN bei den Verbindungen entweder
mit Salzen/Ionenkristallen oder mit Legierungen zu tun, während im
Fall der Nichtmetalle wegen deren großen Elektronegativitäten
entweder kovalente Verbindungen (mit den anderen Nichtmetallen)
oder Salze/Ionenkristalle (mit den Metallen) auftreten.
Da aber die Metallsalze ausführlich in der Vorlesung Chemie der Metalle
behandelt werden, bleibt als Bindungsart, d.h. letztlich als Grund für die Stabilität
der Verbindungen der Nichtmetalle untereinander, vor allem die kovalente Bindung
übrig, so dass in der folgenden, erstmal nur kurzen Übersicht der Bindungsarten
ausführlich nur die kovalente Bindung besprochen werden soll.
Die strukturellen Aspekte der Bindungsarten sind (im Ketelaar-Dreieck)
in der Vorlesung Anorganische Strukturchemie z.B. in
Kap. 1.2. Chemische Bindung und Strukturchemie
ausführlich diskutiert.
Kovalente Bindungen sind stets gerichtet. Aus der organischen Chemie sind
die wichtigsten Prinzipien gut bekannt. Das wichtigste Prinzip
ist das Erreichen der Oktettregel für alle Bindungspartner. Die
Elemente teilen sich jeweils Elektronenpaare, bei Einfachbindungen ein und
bei Doppel- und Dreifachbindungen zwei oder drei Elektronenpaare.
Zur bindungstheoretischen Erklärung wird ein LCAO-Ansatz gemacht, d.h.
die Molekülorbitale werden aus Atomorbitalen zusammengesetzt, wobei
jeweils die Symmetrien der Atomzustände angepaßt werden müssen
(Bildung sog. symmetrieangepaßter Linearkombinationen, SALCs).
Auf den Mitten der Bindungsachsen (!wo wir den Strich für die bindenden Elektronenpaare zeichnen!)
können
sowohl messend als auch theoretisch erhöhte Elektronendichten festgestellt
werden; die Bindungsmitten sind bindungskritische Punkte, d.h. Sattelpunkte
der Gesamtelektronendichte).
Wegen der Elementvielfalt, der besonderen Eigenschaften einiger Elemente,
der größeren Zahl möglicher beteiligter Atomzustände (z.B. d-Orbitale)
und der gelegentlich sehr großen (elektronenreiche Verbindungen) oder kleinen
(elektronenarme Verbindungen) Elektronenzahlen
müssen diese einfachen Konzepte in der
anorganischen Chemie allerdings noch deutlich erweitert werden:
- Beim Bor als typischem Nichtmetall der dritten Hauptgruppe
treten Elektronenmangelbindungen mit sogenannten Mehrzentren-Bindungen auf.
Auch bei anderen Elementen können Clusterverbindungen mit
Elektronenmangel vorkommen.
- Bei elektronenreichen Verbindungen dagegen, z.B. den Interhalogenen, aber
auch bereits bei dem einfachen Sulfat-Ion oder SF6
als Beispiele aus der Schwefelchemie kommt es zur Oktettaufweitung/Hypervalenz, die
8-N-Regel der 1. langen Periode ist nicht mehr erfüllt.
Da die schwereren Elemente neben s- und p- auch über d-Zustände
verfügen, wurden diese Orbitale früher zur Erklärung dieser
Tatsache herangezogen. Die aktuelle Theorie zeigt jedoch, daß hier sogenannte
Hyperkonjugation vorliegt.
- Wie das Beispiel SF6 zeigt, kann die Koordinationszahl
4 auch überschritten werden, was die Strukturen u.U. relativ kompliziert
machen kann (vgl. z.B. die Te-I-Verbindungen).
- Die energetischen Unterschiede zwischen den Zuständen einer Hauptquantenzahl
(z.B. der s-p-Abstand) können dazu führen, daß Hybridisierungen zwischen
s- und p-Zuständen nicht mehr möglich sind, und die Bindungen reinen
p-Charakter haben (sog. s-p-Separation). Damit sind die Analogien fast aller
Nichtmetallverbindungen zur Kohlenstoffchemie begrenzt!
- Wegen starker Unterschiede in den Elektronegativitäten sind die Bindungen
u.U. sehr polar und es kann zu interessanten Übergängen
zur Ionenbindung kommen.
- Bei den schweren Elementen und ihren Verbindungen können auch Übergänge
zur metallischen Bindung beobachtet werden (vgl. die Dimorphie von Phosphor oder Zinn).
- Wegen der sehr elektronegativen Partner wie z.B. Fluor und Sauerstoff
kann es zur Ausbildung starker Wasserstoffbrückenbindungen kommen.
(vgl. die ungewöhnlichen Gänge der Eigenschaften der Verbindungen
H2E mit E=Chalkogen oder die besonderen Eigenschaften von Wasser
oder HF).
- Bei den ganz schweren Elementen sorgen zusätzlich relativistische Effekte
für ungewönliche Bindungsverhältnisse.
- Bei sehr unterschiedlicher energetischen Lage bzw. räumlichen Ausdehnung der Atomorbitale
ist deren Überlappung zu Molekülzuständen erschwert oder unmöglich,
die entsprechenden Verbindungen sind sehr instabil oder unbekannt.
Das Prinzip der kovalenten Bindung also liegt in einem
Teilen von Valenzelektronen in einer Weise, daß jeder Bindungspartner
die Edelgasschale (8er Schale) erreicht. Trotz der genannten Spezialitäten
lassen sich auch in der Anorganischen Chemie die z.T. vielfältigen bzw. komplexen Strukturen
und Bindungsverhätnisse z.T. auch mit einfachen Konzepten/Modellen
relativ gut verstehen und beschreiben:
- Die einfachste Gesetzmäßigkeit dabei ist die simple 8-N-Regel,
nach der jeder Partner aus der Hauptgruppe N in einer kovalenten Verbindung 8-N
Bindungen ausbildet (z.B. Phosphor: N=5, also 8-5=3 Bindungen).
Diese Beschreibung ist identisch mit der Aussage, daß jeder Partner
die Edelgasschale zu erreichen versucht (s. oben zu den Grenzen).
- Die umfassende Beschreibung der kovalenten Bindung erfolgt durch die
MO-Theorie, die meist in ihrem einfachsten Modell, dem sogenannten
LCAO-Ansatz, verwendet wird.
- Für die Details der Strukturen gibt es wiederum gesonderte, z.T. sehr einfache Ansätze
wie z.B. das VSEPR-Konzept (auch Gillespie-Nyholm-Konzeption genannt), das sehr einfach
die Umgebung eines kovalent gebundenen Elementes in einer kovalenten Verbindung
zu erklären vermag. Dieser Ansatz gilt auch bei elektronenreichen Verbindungen.
- Die Wade-Regeln sind empirische Regeln zur Erklärung der Stabilität
von Elektronenmangelverbindungen und Clustern (s. bei Boranen).
- Das eher qualitative HSAB-Konzept berücksichtigt die unterschiedliche Form und energetische Lage
der an der Bildung von Molekülorbitalen beteiligten Atomorbitale.
Im Unterschied dazu brauchen die beiden
anderen Bindungsarten im Rahmen dieser Vorlesung nicht näher in Betracht gezogen zu werden.
Siehe hierzu Kap. 1.4. der Vorlesung Chemie der Metalle.

