Vorlesung Chemie der Nichtmetalle
1. Einleitung
1.1. Metalle - Nichtmetalle: Abgrenzungen, Stellung im PSE
|
Nichtmetalle sind die elektronegativen Elemente, die im Periodensystem rechts oben
stehen. Es handelt sich um typische Anionenbildner.
Als Kennzeichen nichtmetallischer Elemente können zunächst
genannt werden:
- Die Elemente sind Gase (Edelgase, Wasserstoff, Fluor, Chlor, Sauerstoff, Stickstoff),
Flüssigkeiten (Brom) oder Festkörper ohne metallischen Glanz (Schwefel, weißer Phosphor),
die meistens durchsichtig sind.
- Die festen Elemente sind schlechte elektrische Leiter (Ausnahme: Graphit).
- und meist auch schlechte Wärmeleiter (Ausnahme: Diamant).
- Die Halbleiter wie Silicium, Bismut, Selen und Tellur bilden den Übergang
zu den Metallen (s.u.). Ihre Bandlücken sind klein und die Elemente
sind schwarz oder bereits von metallischem Glanz (s. Abb. 1.1.1.).
 |
 |
 |
 |
 |
| Bor |
Silicium |
Schwefel |
Selen |
Tellur |
| Abb. 1.1.1.: Fotos von nichtmetallischer Elementen an
der Grenze zu den Metallen |
Dagegen stehen die physikalischen Eigenschaften metallischer Elemente:
- metallisches Aussehen, d.h. metallischer Glanz der Oberfläche
- undurchsichtig
- duktil, dehnbar
- gute Wärmeleitfähigkeit
- gute elektronische Leitfähigkeit σ, d.h. geringer elektrischer
Widerstand ρ
Außer den Unterschieden in der Temperaturabhängigkeit (s.u.) der
elektronischen Leitfähigkeit unterscheiden sich auch die
Werte für die Leitfähigkeiten
bzw. der elektrische Widerstand als
Kehrwert der Leitfähigkeit)
beim Übergang vom Metall zum Nichtmetall gravierend:
| Leiter |
Stoffklasse |
Substanz |
spezifischer elektr. Widerstand
| Bandlücke ΔE
|
| [Ω m] bei 25oC |
[eV] bei 0 K |
| 1. Klasse |
Metalle |
Cu |
1.7 * 10-8 |
keine |
| Li |
8.6 * 10-8 |
keine |
| Halbmetalle |
As |
3.5 * 10-7 |
0 |
| Bi |
1.2 * 10-6 |
0 |
| C (Graphit) |
0.8 * 10-5 |
0 |
| 2. Klasse |
Halbleiter |
Te |
2 * 10-3 |
0.33 |
| Si |
1 * 101 |
1.17 |
| Nichtmetalle |
Glas |
109 |
>> 3 eV |
| S |
1014 |
>> 3 eV |
| C (Diamant) |
|
5.4 eV |
Tab. 1.1.1. Elektrische Leitfähigkeiten ausgewählter Stoffe
Für die genaue Eingruppierung und die Trennung der Nichtmetalle von den Metallen
aus physikalischer Sicht ist die
Temperaturabhängigkeit der elektrischen Leitfähigkeit σ maßgeblich. Danach unterschiedet man in:
- Leiter 1. Klasse (z.B. Metalle oder Halbmetalle), bei
denen eine Temperaturerhöhung zu einer Verringerung
der Leitfähigkeit, d.h. zu einer Erhöhung des elektrischen Widerstands führt.
- Leiter 2. Klasse (z.B. Isolatoren oder Halbleiter), bei
denen genau die umgekehrten Effekte auftreten. Mit der Temperatur
nimmt die Leitfähigkeit zu, der Widerstand entsprechend ab.
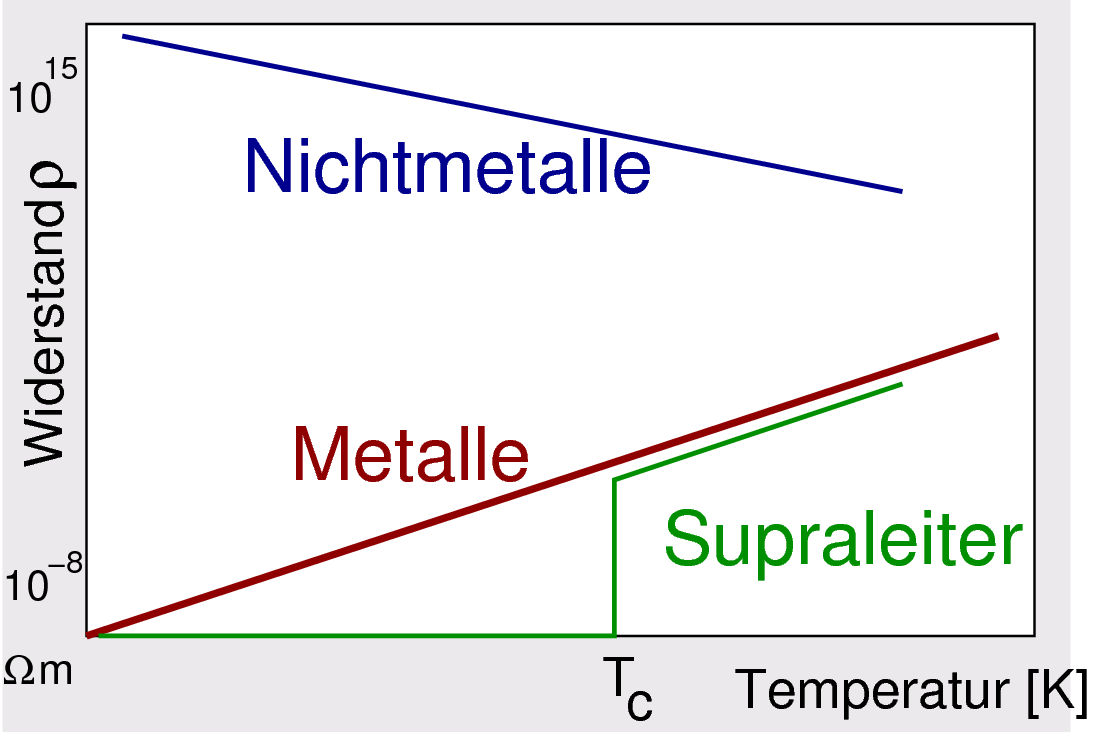 |
| Abb. 1.1.2. Temperaturabhängigkeit des elektrischen Widerstands ρ
‣SVG
|
Die Abbildung 1.1.2. zeigt den typischen Verlauf des elektrischen
Widerstands für die beiden Leiterklassen.
Zur Erklärung dieser Abhängigkeit ist wichtig, daß die elektronische Leitfähigkeit
neben der Ladung der Elektronen (e), von der Zahl der Ladungsträger (N) und
deren Beweglichkeit (B) bestimmt wird:
σ = e N B
- Bei den Leitern 1. Klasse (d.h. bei Metallen und Halbmetallen)
bleibt die Zahl der Ladungsträger gleich und hoch, es
kommt aber bei Erhöhung der Temperatur zu einer stärkeren Bewegung der
Atomrümpfe und dadurch zu einem höherer Widerstand.
Entscheidend ist hier also die Abnahme der Beweglichkeit der Ladungsträger mit
steigender Temperatur.
- Bei Nichtmetallen und Halbleitern, d.h. bei den Leitern 2. Klasse
werden dagegen bei höherer Temperatur erst mehr Elektronen aus den Atomrümpfen freigesetzt,
d.h. hier kommt es zu einer Zunahme der Zahl der Ladunsgträger mit steigender Temperatur.
Die Gruppierung in Metalle und Nichtmetalle aus bindungstheoretischer Sicht
hängt mit diesen physikalischen Messungen natürlich direkt zusammen.
Entscheidend ist der energetische Abstand zwischen besetzten und unbesetzten elektronischen Zuständen,
im MO-Modell der Molekülchemie der HOMO-LUMO-Abstand.
Molekülverbindungen (ohne ausgedehnte Wechselwirkungen der Atomorbitale) sind damit Nichtmetalle.
In allen Festkörpern kommt es unabhängig vom Bindungstyp zu einer
Wechselwirkung sehr vieler Atomorbitale miteinander, die zu
einer Verbreiterung der Energieniveaus führt. Im Extremfall
(s. Abb. 1.1.3. rechts) entsteht dabei ein kontinuierlicher Bereich
erlaubter elektronischer Zustände (Grenzfall Elektronen im potentialfreien Kasten),
ein einfaches Modell für ein Metall.
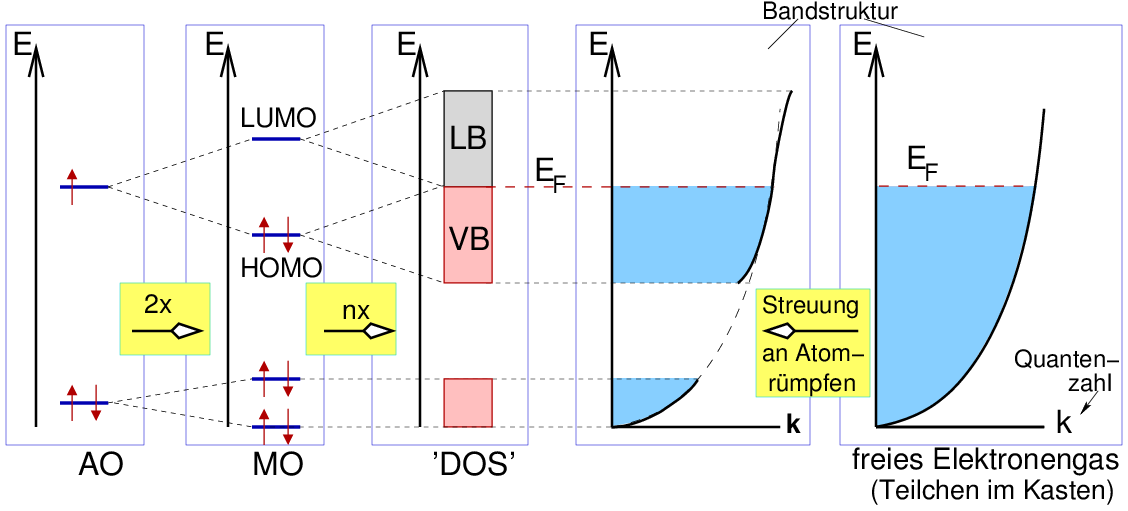 |
| Abb. 1.1.3. Beschreibung der Bindung
in Feststoffen (rechts: Metall, vgl. Elektron im Kasten)
‣SVG
|
Aufgrund der Zustandsdichten (DOS = Density of States = Zustandsdichte, s. Abb. 1.1.4.)
können die Feststoffe dann eingeteilt werden in:
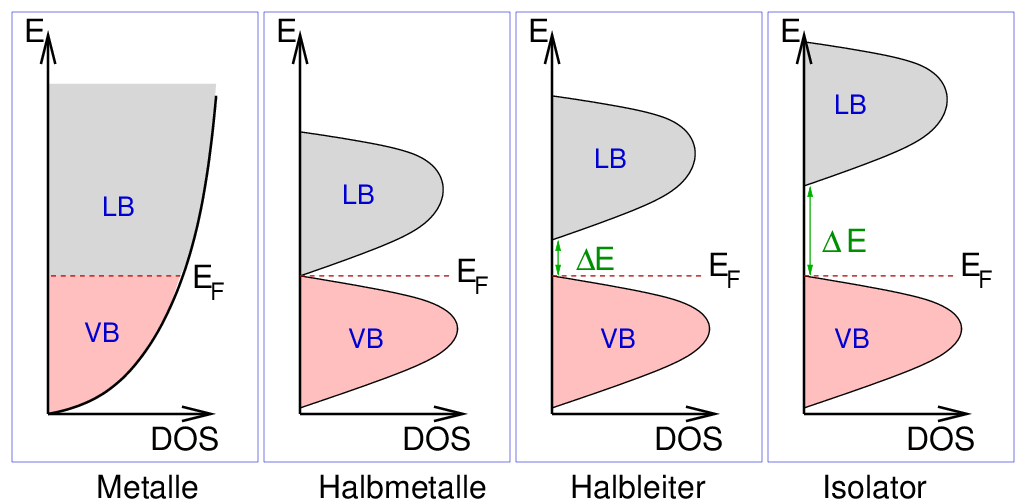 |
| Abb. 1.1.4. Zustandsichten in Metallen, Halbmetallen,
Halbleitern und Isolatoren
‣SVG
|
- Metalle: überlappende (z.B. Ca) oder teilbesetzte (z.B. Na) Bänder.
- Halbmetalle: einander gerade berührende Valenz- und Leitungsbänder (keine Bandlücke, aber
nur sehr geringe DOS am Fermi-Niveau).
- Halbleiter: schmale (ca. 1-2 eV) verbotene Zone zwischen Valenz- und Leitungsband
- Isolatoren: große verbotene Zone zwischen besetztem Valenz- und leerem Leitungsband
Da für die elektronischen Eigenschaften (elektronische Leitfähigkeit)
nur die energiereichen Elektronen des obersten Bereichs des Valenzbandes verantwortlich sind,
folgt daraus die oben zur Unterscheidung genannte elektronische Leitfähigkeit:
- Leiter 1. Klasse:
- Δ E = 0, DOSEF groß --> Metalle
- Δ E = 0/sehr klein (Richtwert: kT = 0.03 eV = 30 kJ/mol),
DOSEF = 0/sehr klein --> Halbmetalle
- Leiter 2. Klasse:
- Δ E = 1 - 3 eV --> Halbleiter
- Δ E > 3 eV --> Nichtleiter (Isolatoren)
Für die optischen Eigenschaften ('Absorptionsfarbe') folgt aus dem Energiebereich des sichtbaren Lichtes
(1.5 - 3.0 eV), dass alle Feststoffe mit Bandlücken kleiner 1.5 eV schwarz (oder bei sehr
kleinen Bandlücken metallisch glänzend)
erscheinen. Stoffe mit breiten Leitungsbändern und Bandlücken zwischen 1.5 und 3.0 eV
sind farbig, mit Farben zwischen gelb -- orange -- rot -- violett-braun -- schwarz (vgl. Metall-Sulfide).
Die Grenze zwischen Metallen und Nichtmetalle
im Periodensystem
ist ebenfalls nicht ganz eindeutig zu ziehen. Eine Reihe von Elementen bildet
zusätzlich mehrere Modifikationen mit unterschiedlichen elektrischen Eigenschaften und elektronischen Strukturen:
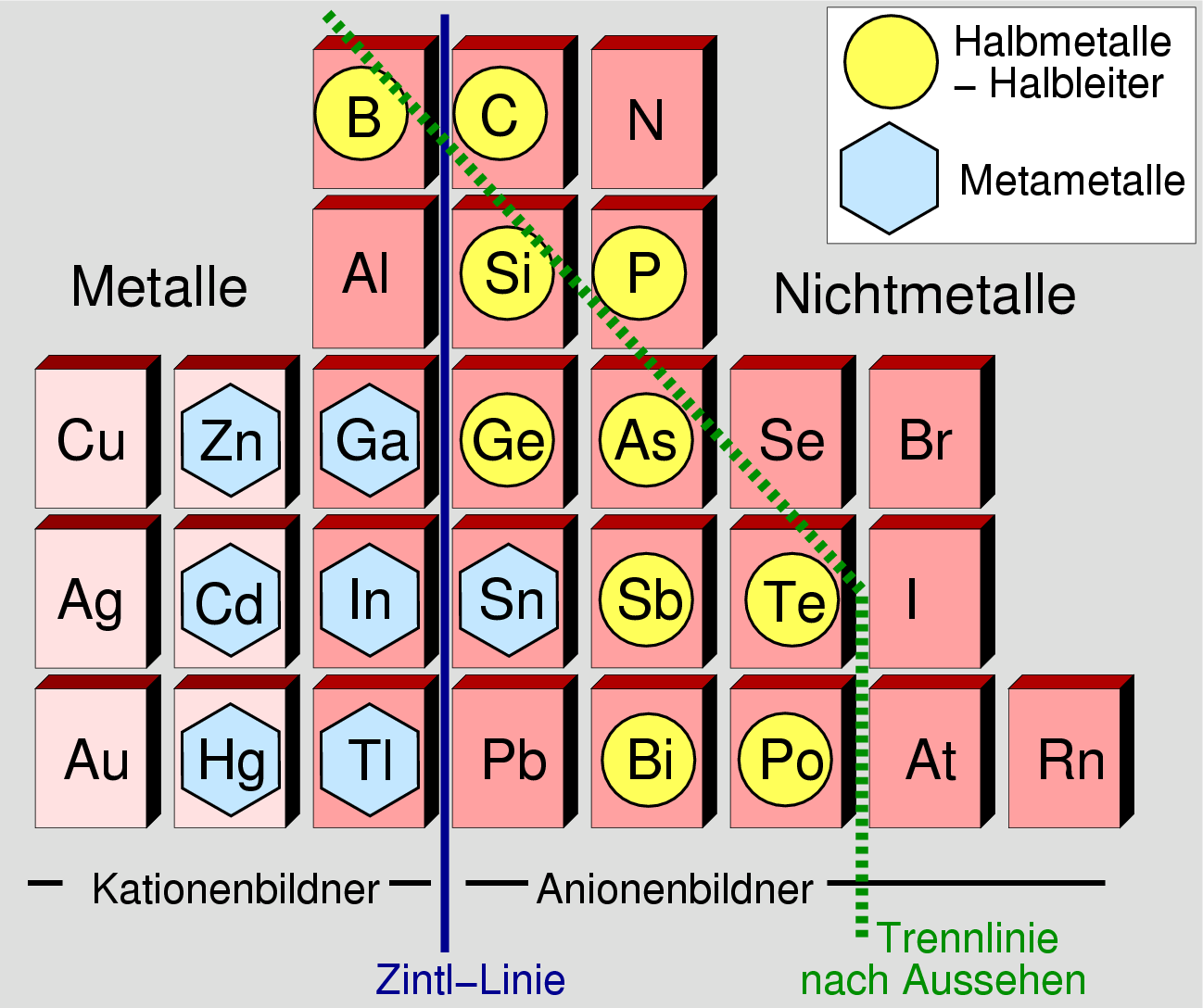 |
| Abb. 1.1.5. Details zur Grenze zwischen Metallen und Nichtmetallen im Periodensystem
‣SVG
|
Einige Punkte zur Erläuterung der Grenze Metalle - Nichtmetalle in der obigen Abbildung:
- Die Elemente der Nebengruppen sind hellrosa, die Elemente der Hauptgruppe (p-Block)
hellrot gekennzeichnet. Alle Elemente links des gezeigten Ausschnitts sind
echte Metalle, alle Elemente rechts echte Nichtmetalle!
- Die grün eingezeichnete Linie bezeichnet eine Grenze nach Aussehen
der Elemente. Kritisch wird die Einstufung z.B. bei Kohlenstoff
(Graphit und Diamant als Polymorphe) oder bei Bi (extrem kleine Bandlücke).
- Gelegentlich werden auch noch weiter unterschieden:
- Halbmetalle (hier durch gelbe Kreise gekennzeichnet) sind
spröde und dehnen sich beim Erwärmen aus. Sie haben überwiegend
kovalente Strukturen (die 8-N-Regel für die Bindigkeit ist erfüllt), sehen aber schon metallisch
aus. Sie haben keine oder nur eine winzig kleine Bandl¨cke, die
Zustandsdichte am Ferminiveau ist 0.
- 'Meta'-Metalle (hier durch blaue Sechsecke gekennzeichnet)
bilden die Übergangsglieder zwischen Metallen und Halbmetallen.
Diese Elemente haben besondere, meist von echten Metallpackungen
durch Verzerrung abgeleitete Strukturen. Physikalische sind sie echte Metalle (Leiter 1. Klasse).
- Aluminium und Blei liegen als echte Metalle mitten im Übergangsbereich!
- Als 'chemische' Trennung zwischen Metallen (d.h. Kationenbildnern) und
Nichtmetallen (d.h. Anionenbildnern) kann die sogenannte 'Zintl-Linie'
(oben als blaue Linie zwischen der III. und der IV. Hauptgruppe eingezeichnet)
angesehen werden. Allerdings gilt auch diese Grenze nicht streng, wie die von Zintl
selber gefundene Verbindung NaTl belegt, in der ein Diamant-analoger
Tl--Anionenverband vorliegt.
- Als Grenze für die Vorlesungen Chemie der Metalle und Chemie der Nichtmetalle
wird etwas willkürlich die in Abb. 1.1.6. grün eingezeichnete Linie verwendet:
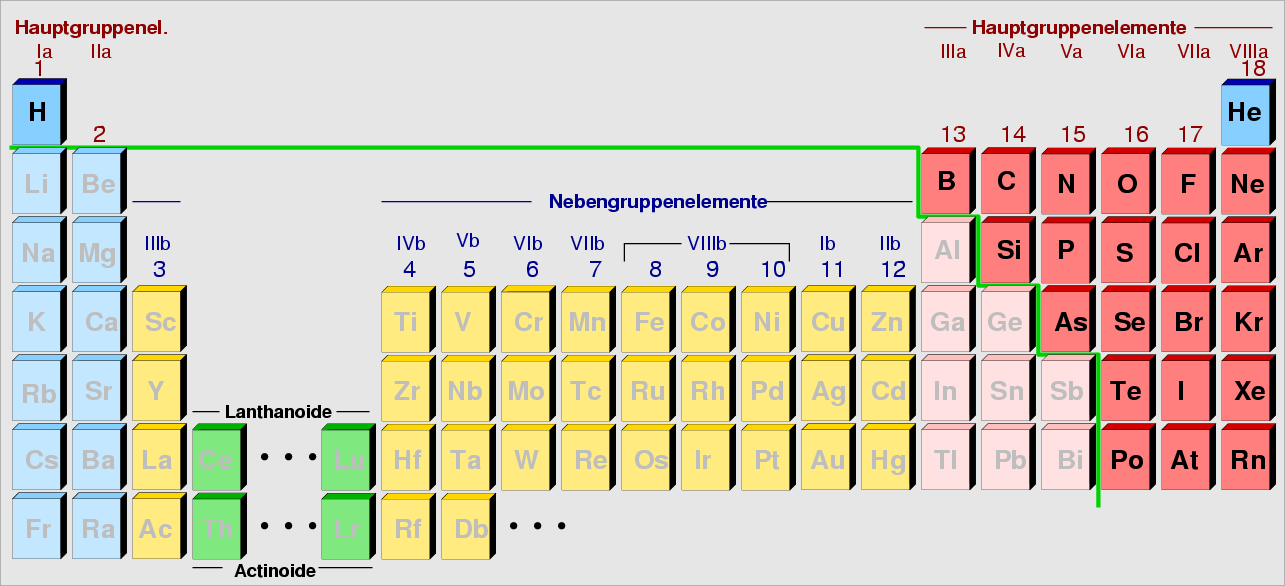 |
| Abb. 1.1.6. Nichtmetalle im Periodensystem
‣SVG
|
Aus den aus der Grundvorlesung und dem Einführungskurs bekannten Tendenzen
atomarer Größen im Periodensystem
(s. Abb. 1.1.7) und aus der Tatsache, daß die nichtmetallischen Elemente im PSE rechts oben
zu finden sind, lassen sich weitere allgemeine Eigenschaften angeben:
 |
| Abb. 1.1.7. Tendenzen verschiedener Elementeigenschaften im Periodensystem
‣SVG
|
- Die Ionenradien (für Ionen mit Edelgasschale) sind groß,
- die Atomradien/Abstände im Element dagegen klein.
Alle Radien steigen mit der Ordnungszahl in einer Gruppe. Mehrfachbindungen
beeinflussen die Gänge innerhalb einer Periode erheblich.
- Die Elektronenaffinität der Nichtmetalle ist negativ (!), die Bildung
von Anionen also begünstigt.
Die Elektronenaffinität fällt im PSE von links nach rechts und
steigt von oben nach unten.
Sie ist bei den Erdalkalimetallen (gefüllte s-Unterschale) und bei
den Elementen der Stickstoff-Gruppe (halbbesetzte p-Unterschale) weniger negativ.
- Die 1. Ionisierungsenergie der Nichtmetalle ist groß (positiv!), die Bildung von Kationen also
sehr unwahrscheinlich.
Die Ionisierungsenergie steigt im Periodensystem von unten nach oben und von links nach
rechts.
- Nichtmetalle haben große Elektronegativitäten.
Da die Elektronegativität über die Summe von IE und EA definiert wird und
die absoluten Werte der 1. Ionisierungsenergie deutlich größer sind als die
der Elektronenaffinität, verläuft die Elektronegativität im Periodensystem
parallel mit der 1. Ionisierungsenergie.
- Die Sauerstoffverbindungen der Nichtmetalle reagieren sauer, sind also die Anhydride starker Säuren.
In der Vorlesung werden die nichtmetallischen Elemente im Wesentlichen
von rechts nach links besprochen, und zwar
- Wasserstoff, und seine Sonderstellung im Periodensystem.
- Die Chemie aller Elemente aus den Gruppen der Edelgase, Halogene und Chalkogene.
- Von den Pentelen die ersten drei Elemente, Stickstoff, Phosphor und Arsen (Sb und Bi sind bei den Metallen enthalten).
- Aus der Gruppe der Tetrele werden nur Kohlenstoff und Silicium (nicht Ge, Sn und Pb) besprochen.
- Das Bor wird als einziges Element der III. (13.) Gruppe behandelt.
Zu jeder Gruppe von Elementen werden jeweils die Elemente selber,
d.h. ihr Vorkommen, die Gewinnung, Eigenschaften, Struktur, Nachweis und Herstellung besprochen.
Es folgen jeweils wichtige Verbindungen, diese wiederum nach dem Periodensystem geordnet, d.h.
zunächst die Wasserstoffverbindungen, dann die Edelgasverbindungen, die Halogenide und die Chalkogenide.
Da diese Vorlesung leider keine Experimentalveranstaltung ist, wird möglichst immer ein
Bezug zum Praktikum und zur Grundvorlesung hergestellt. Da die wässrige Chemie der Anionen
aus der Analytik bereits bekannt ist, entfallen diese Aspekte hier weitgehend.
Wichtig sind außer den Grundlagen zu den Elementen vor allem
- technisch wichtige Verfahren zur Herstellung wichtiger Grundstoffe
- sowie an geeigneten Stellen ausführliche Exkurse zu Konzepten
der chemischen Bindung in Nichtmetall-Verbindungen.
Konkret ergibt sich für die Vorlesung Chemie der Nichtmetalle
die folgende Inhaltsübersicht:
- Einleitung, Allgemeines
- Wasserstoff (H)
- Edelgase (8. Hauptgruppe: He, Ne, Ar, Kr, Xe, Rn)
- Halogene (7. Hauptgruppe: F, Cl, Br, I, At)
- Chalkogene (6. Hauptgruppe: O, S, Se, Te, Po)
- Pentele (Pnicogene, 5. Hauptgruppe, Stickstoff-Gruppe: N, P, As)
- Tetrele (4. Hauptgruppe: C, Si)
- Bor (Triele, 3. Hauptgruppe)
Für alle Nichtmetalle gemeinsam sind noch die folgenden beiden Teilkapitel
- 1.2 Chemische Bindung in Nichtmetallen und ihren Verbindungen
- 1.3 Literturhinweise















