
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |
| Cluster | Formel | Verbindung | formale Zerlegung | Farbe | Mp | GIF |
| zwei flächenverknüpfte Oktaeder | M9O2 | Rb9O2 | - | kupferfarben | 40.2oC | |
| Rb6O | 2*: -> 3 M + M9O2 | bronzefarben | Zp: 7 oC |  |
||
| drei flächenverknüpfte Oktaeder | M11O3 | Cs11O3 | - | violett | 52oC |  |
| Cs4O | 3*: -> M + M11O3 | rotviolett | Zp=10oC | |||
| Cs7O | 3*: -> 10 M + M11O3 | bronzefarben | 4.3 oC | |||
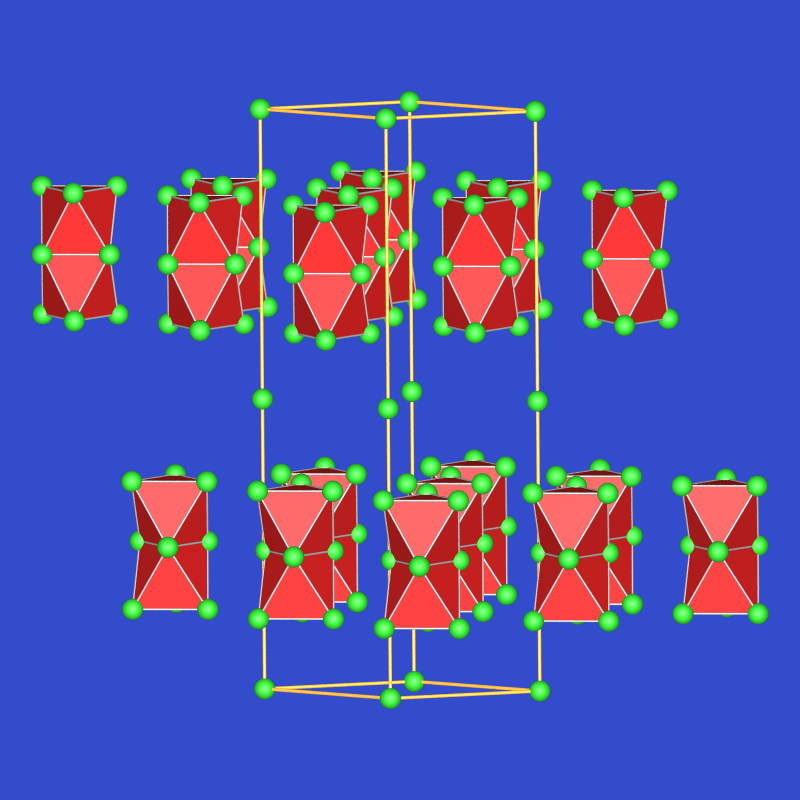
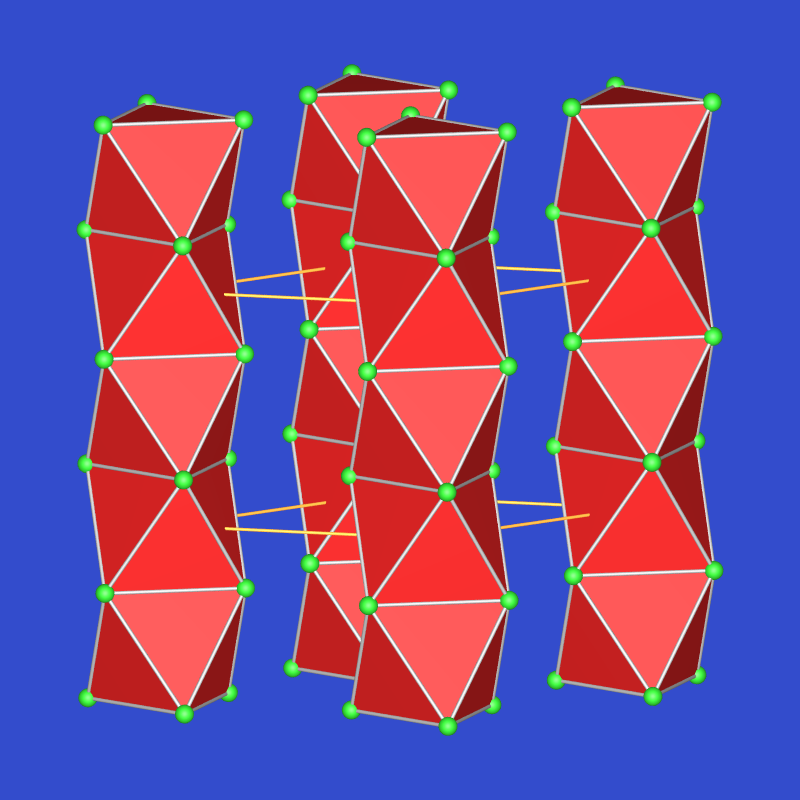
| Oktaederketten | M3O | Cs3O | anti-ZrI3-Typ | blaugrün | Zp=166 oC |  |
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |