| Radienverhältnis | rM,exp | Strukturtyp | CN(M) | Packung |
| > 0.732 | > 80 | CaF2 | 8 | Kationen bilden fcc |
| 0.414-0.732 | 80-55 | Rutil | 6 | Anionen bilden hcp, M in 1/2 der OL |
| < 0.414 | < 55 | SiO2 | 4 |
- Die Fluorit-Struktur liegt in allen bekannten Lanthanoid-(IV)-Oxiden vor. Außer den Oxiden von Ce, Pr und Tb (Ln mit großen Kationenradien) kristallisieren auch die Actinid-Oxide von Th, Pa, U, Np und Pu in diesem Strukturtyp.
- Der Rutil-Typ ist der
wichtigste Strukturtyp bei den MO2-Oxiden
 der Übergangsmetalle. Die Oxidionen bilden eine annähernd hexagonal
dichte Kugelpackung, in der die M-Kationen die Hälfte der
Oktaederlücken besetzen. Die TiO6-Oktaeder
sind über zwei Kanten miteinander zu linearen Ketten verknüpft, die wiederum
über Ecken dreidimensional vernetzt sind (CNO = 3).
Diesen Strukturtyp bilden die Übergangsmetalloxide von Ti bis Mn
(beta-MnO2), von Nb bis Co und von Ta bis Pt.
Außerdem kristallisieren GeO2 und SnO2 (Kassiterit, Zinnstein)
sowie PbO2 in diesem Typ.
der Übergangsmetalle. Die Oxidionen bilden eine annähernd hexagonal
dichte Kugelpackung, in der die M-Kationen die Hälfte der
Oktaederlücken besetzen. Die TiO6-Oktaeder
sind über zwei Kanten miteinander zu linearen Ketten verknüpft, die wiederum
über Ecken dreidimensional vernetzt sind (CNO = 3).
Diesen Strukturtyp bilden die Übergangsmetalloxide von Ti bis Mn
(beta-MnO2), von Nb bis Co und von Ta bis Pt.
Außerdem kristallisieren GeO2 und SnO2 (Kassiterit, Zinnstein)
sowie PbO2 in diesem Typ.
- Der CaCl2-Typ ist dem Rutil nahe verwandt und basiert auf einer unverzerrten hexgaonal dichten Anordnung der Oxidionen. Diesen Typ bildet die Hochdruckmodifikation beta-PtO2.
- Neben der Rutilmodifikation (thermodynamisch stabil)
kennt man von TiO2 zwei weitere
Modifikationen,
den Brookit und den Anatas (beide metastabil).
Während im Rutil
zwischen den TiO6-Oktaedern jeweils zwei gemeinsame Kanten
auftreten, haben die Oktaeder im
Brookit
drei gemeinsame Kanten (Stapelfolge ABAC der O-Atome).
Die Anatas-Modifikation
basiert auf einer fcc-Packung, in der die Hälfte
der Oktaederlücken gefüllt ist. Die [TiO6]-Oktaeder
sind hier über vier Kanten verknüpft.
Fotos der Minerale (externe Links):
und von anderen Verbindungen mit TiO2-Strukturen:- Foto Pyrolusit MnO2
- Mineralogie Ramsdellit MnO2
- Eine Besonderheit bei den MO2-Oxiden ist
ZrO2. Das Oxid bildet drei verschiedene Modifikationen.
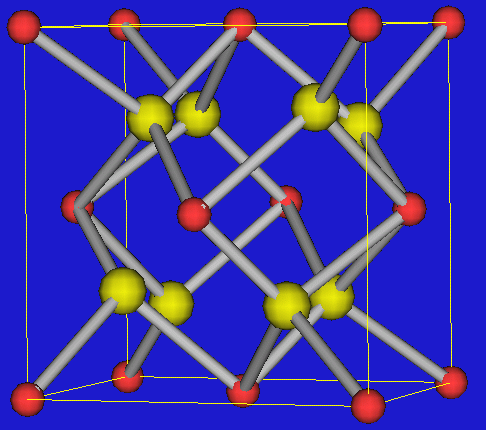 Der Ionenradius von Zr4+ beträgt 71 pm, und ist damit
'zu groß' für die Rutil-Modifikation (CN=6) (für die Ionenradien
rM von 60 bis 70 pm charakteristisch sind) und 'zu klein'
für den Fluorid-Typ mit CN=8, der z.B. bei rCe4+ = 87 pm
und rPu4+ = 86 pm vorliegt.
Entsprechend bildet die Raumtemperaturphase von ZrO2 eine
Struktur mit der Koordinationszahl 7 für Zr.
ZrO2 ist insgesamt 3 phasig:
Die monokline
Baddeleyit-Modifikation (Abb.
rechts) (CNZr=7)
geht oberhalb 1100 oC
in einen tetragonal verzerrten Fluorit-Typ über (CN 4+4), der
bei weiterer Temperaturerhöhung in die ideale kubische Fluoritstruktur
(CN=8) übergeht.
HfO2 bildet ebenfalls die Raumtemperatur-Struktur von
ZrO2.
Der Ionenradius von Zr4+ beträgt 71 pm, und ist damit
'zu groß' für die Rutil-Modifikation (CN=6) (für die Ionenradien
rM von 60 bis 70 pm charakteristisch sind) und 'zu klein'
für den Fluorid-Typ mit CN=8, der z.B. bei rCe4+ = 87 pm
und rPu4+ = 86 pm vorliegt.
Entsprechend bildet die Raumtemperaturphase von ZrO2 eine
Struktur mit der Koordinationszahl 7 für Zr.
ZrO2 ist insgesamt 3 phasig:
Die monokline
Baddeleyit-Modifikation (Abb.
rechts) (CNZr=7)
geht oberhalb 1100 oC
in einen tetragonal verzerrten Fluorit-Typ über (CN 4+4), der
bei weiterer Temperaturerhöhung in die ideale kubische Fluoritstruktur
(CN=8) übergeht.
HfO2 bildet ebenfalls die Raumtemperatur-Struktur von
ZrO2.
| << Zusammensetzung M2O3 | Anfang Kap. 3.3.3 | Zusammensetzung M2O5 >> |
| Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 |