 |
| Abb. 2.2.5.1. p-T-Diagramm von Kohlenstoff ‣SVG |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
Nach der 8-N-Regel sind die Elemente der IV. Hauptgruppe 4-bindig. Aufgrund der VSEPR-Regeln bzw. der Hybridisierung bilden sich Raumnetze (Diamant-Struktur). Nur wenn, wie beim Kohlenstoff, zusätzlich Doppelbindungen ausgebildet werden können, sind auch niederdimensionalere Bauverbände (Schichten wie im Graphit, Ketten wie in den Nanoröhrchen oder Moleküle wie in den Fullerenen) als Strukturelemente möglich.
 |
| Abb. 2.2.5.1. p-T-Diagramm von Kohlenstoff ‣SVG |
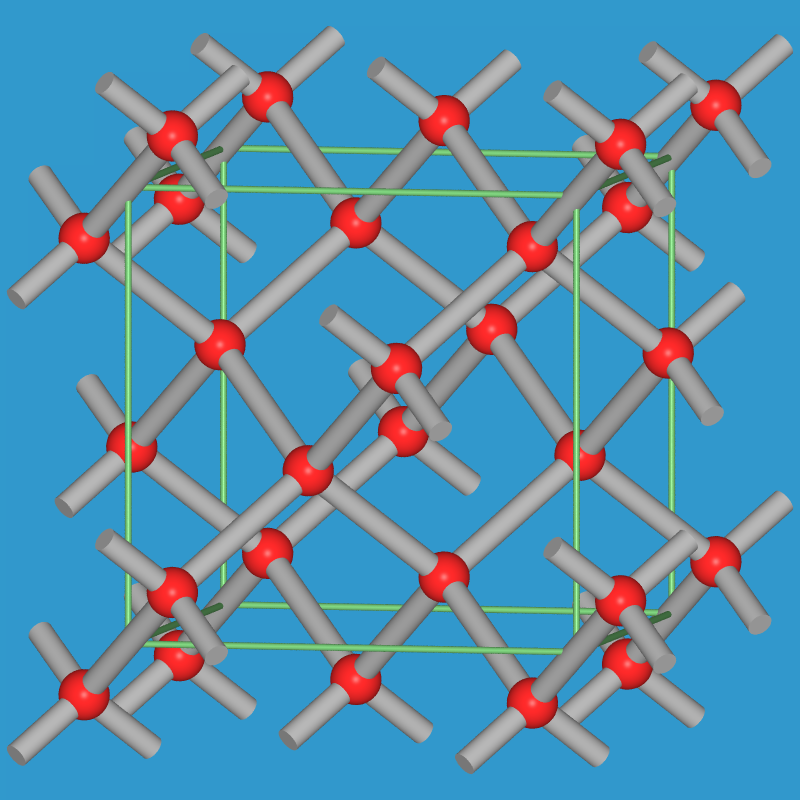
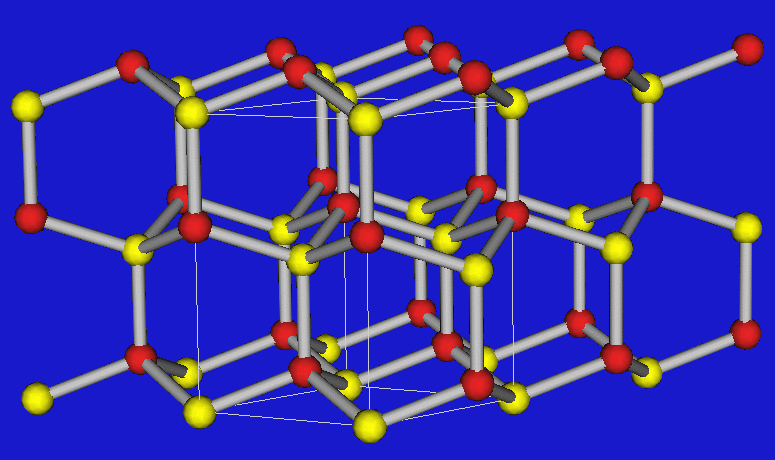
| Diamant | kubisch | hexagonal |
| . |  |
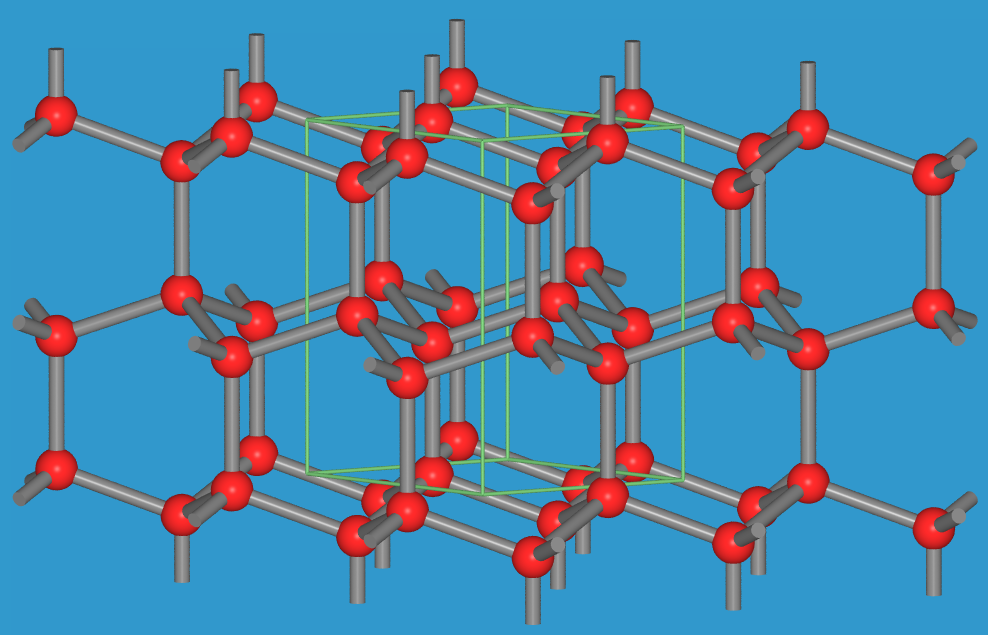 |
| VRMLs | Diamantstruktur (s.a. ST-DB) | hexagonaler Diamant und hier mit anderem Ursprung |
| Sechsringe | alle in Sessel-Konformation | in der Schicht Sessel-, dazwischen Wannen-Konformation |
| Stapelfolge | |:ABC:| | |:AB:| |
| direkter Vergleich |
 |
|
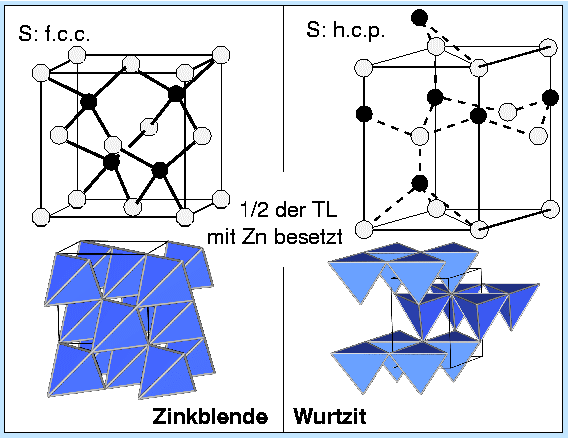
| Ordnungsvariante (ZnS) | 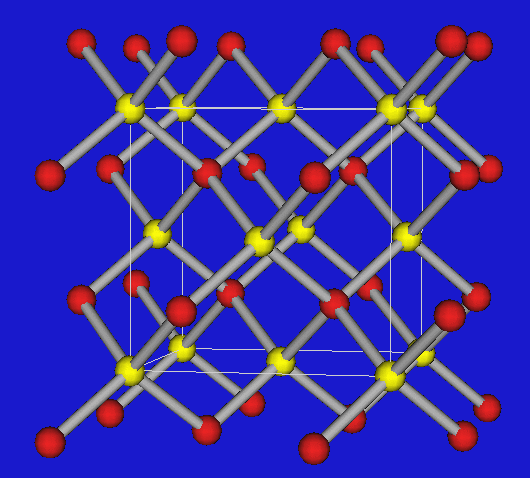 |
 |
| Zinkblende | Wurtzit | |
| Zahl/Größe der Lücken | 1 pro 1 C-Atom -> kleine Lücken | 1 pro 2 C-Atome -> große Lücken |
| gestopfe Varianten (Zintl-Phasen) | 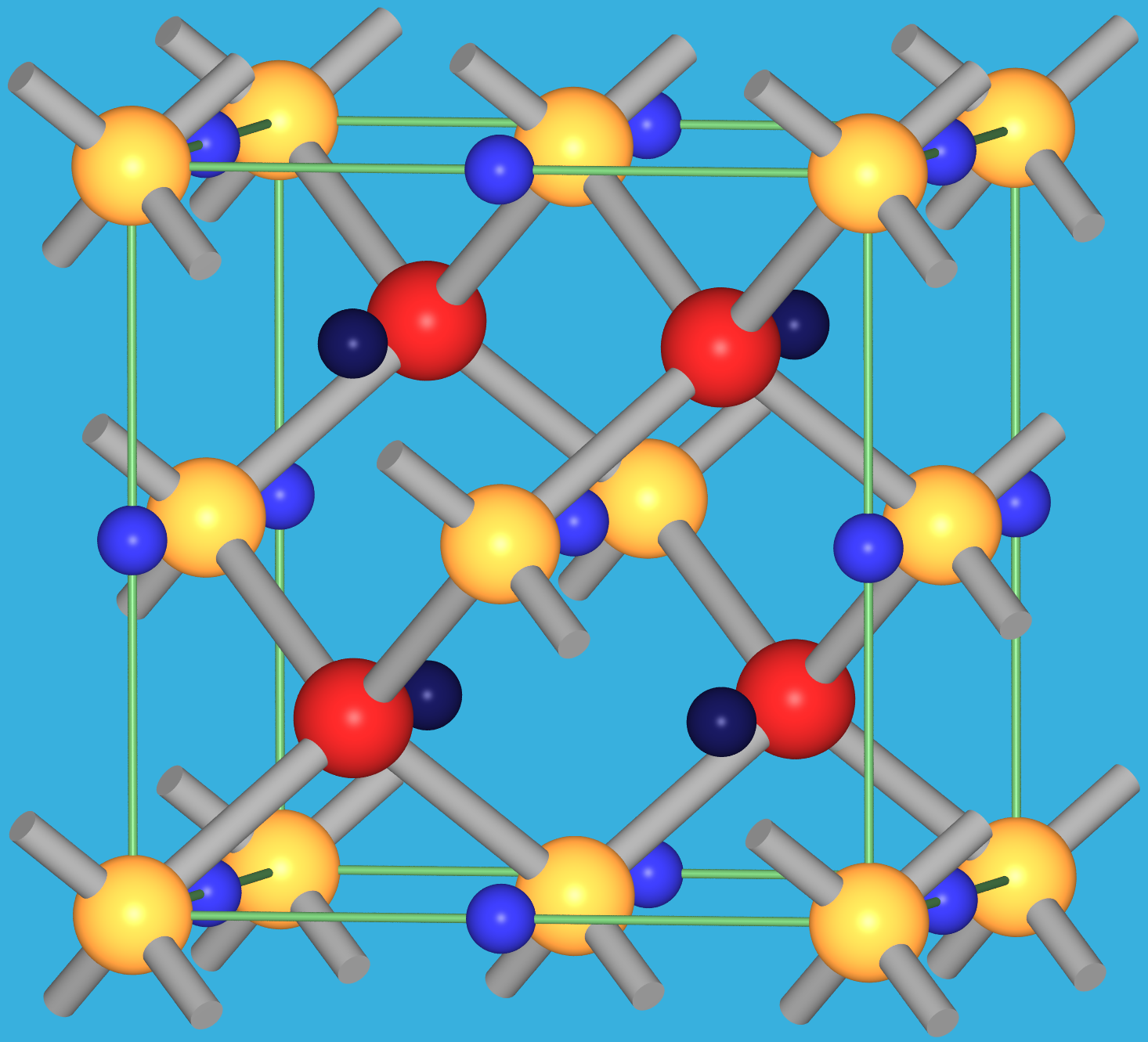 |
 |
| NaTl (!! zwei kristallographisch unterschiedliche Na-Lagen !!) |
CaGa2 | |
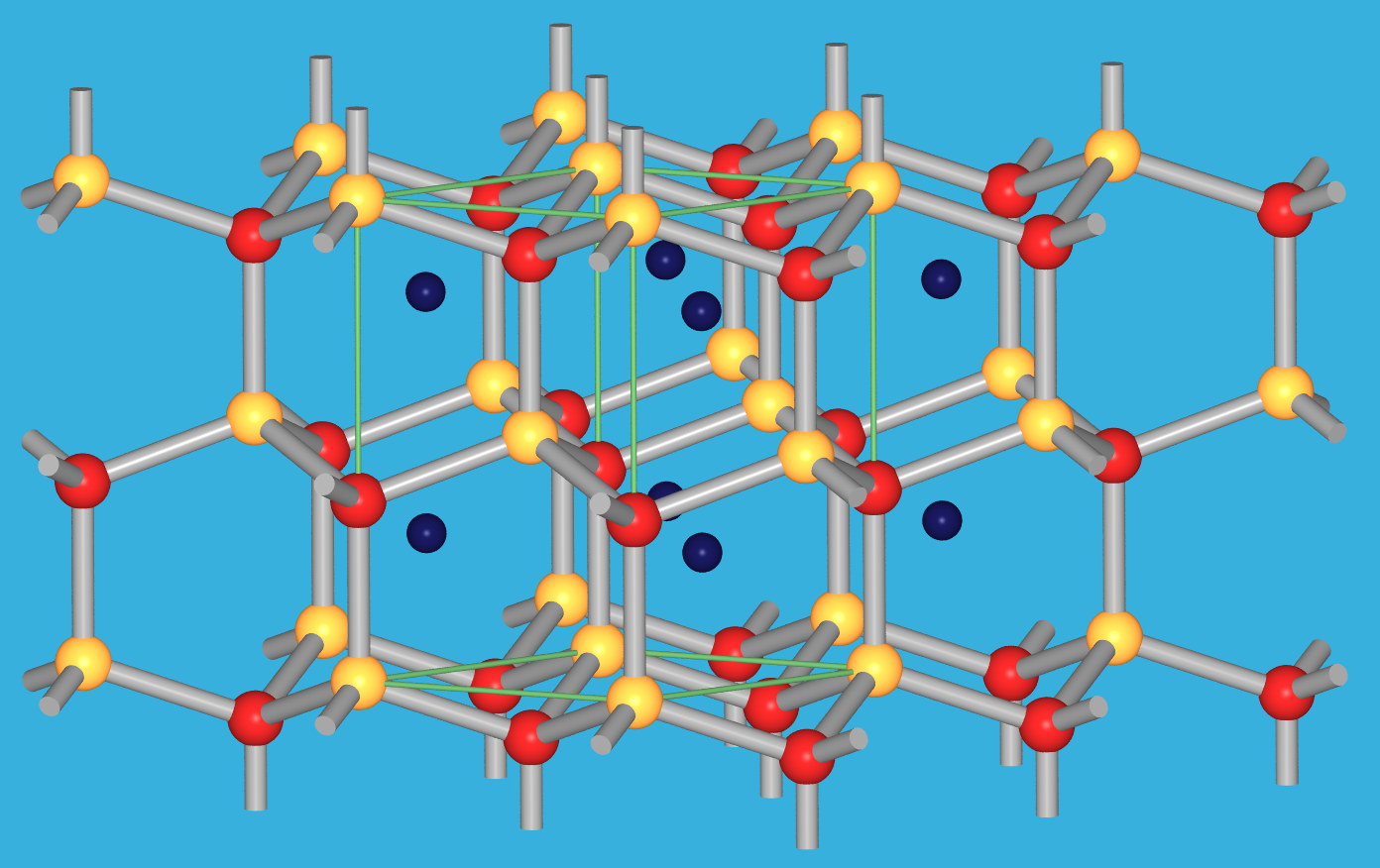
| weitere Atomumgebung und deren Konsequenz für das Auftreten der Ordnungsvarianten | 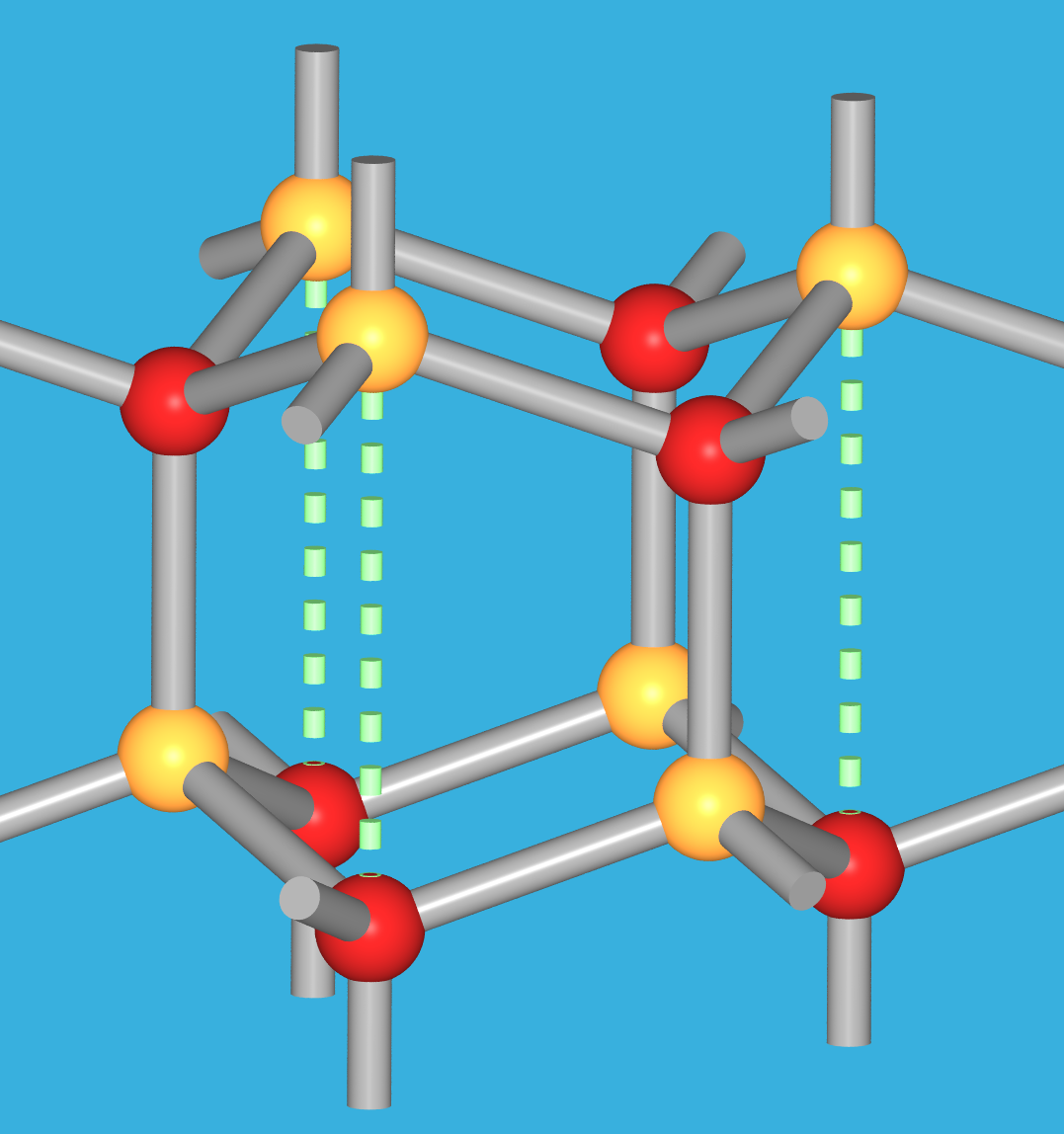 |
|
| CN = 4 + 12 (Kuboktaeder) + 12 | CN = 4 + 12 (Antikuboktaeder) + 1 + 9 | |
| Elemente und weitgehend kovalente Ordnungsvarianten | Der eine nur hier relativ kurze Kontakt (gestrichelte grüne Stäbe) zwischen (bei ionischen Verhältnissen ungleich geladenen) Atomen bedingt die Ausbildung der Wurtzit-Struktur bei deutlich ionischen Ordnungsvarianten wie z.B. ZnO, BeO oder AlN. s. Kap. 2.3.2.. | |
Wie man die beiden Grundformen von Diamant ableiten und zeichnen kann, zeigt das folgende Video:
| Video zur Zeichnen und Erklärung der beiden Diamantstrukturen (59MB|MP4|H264) |
Durch sp2-Hybridisierung (CN 3, trigonal planare Koordination) können weitere Modifikationen erklärt werden:

|

|
| Abb. 2.2.5.3. winzige Kristalle von natürlichem Graphit (links) und ein Graphit-Tiegel (rechts). | |
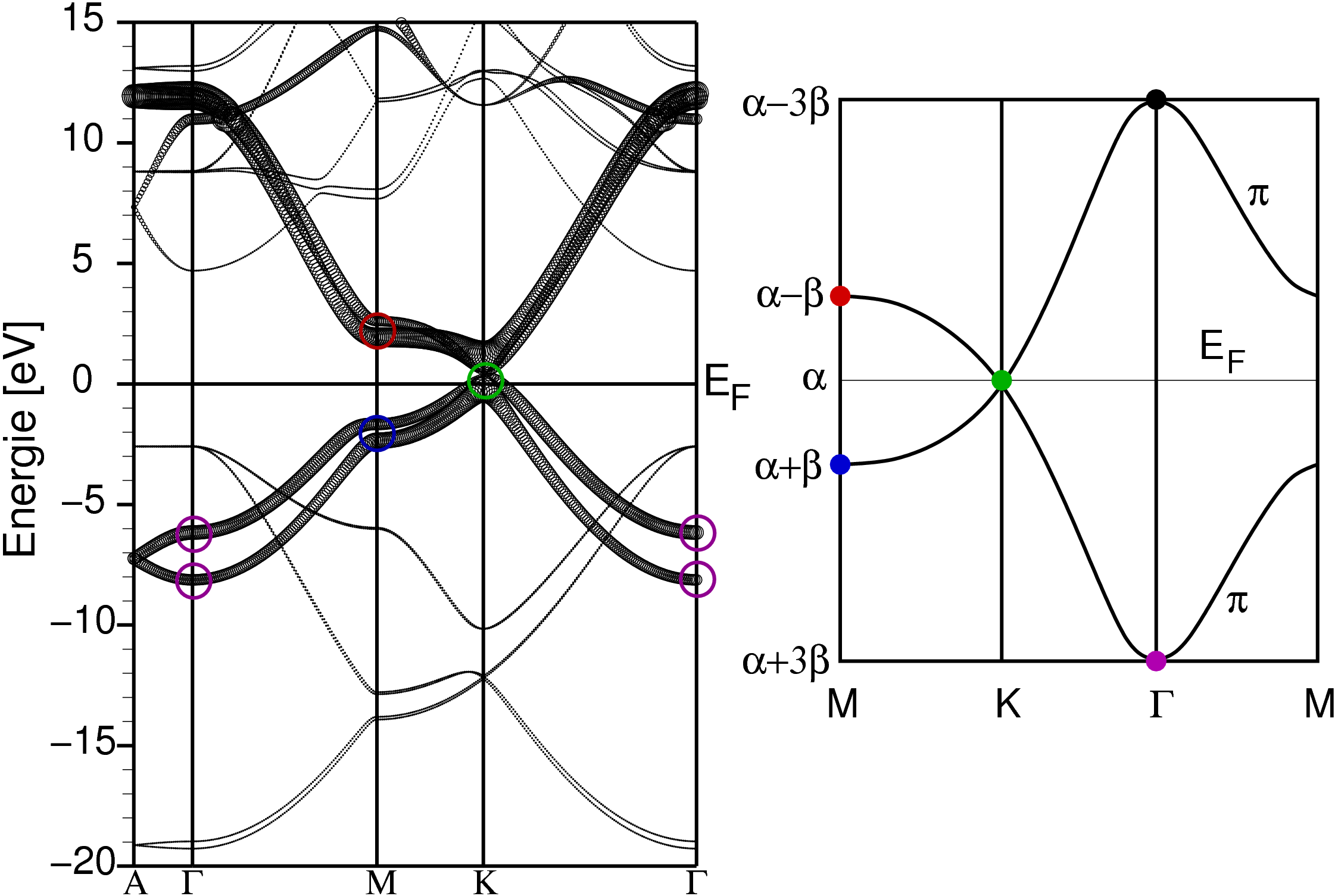 |
| Abb. 2.2.5.4. Banstruktur von Graphit (pz-Fatband-Plot) ‣SVG |
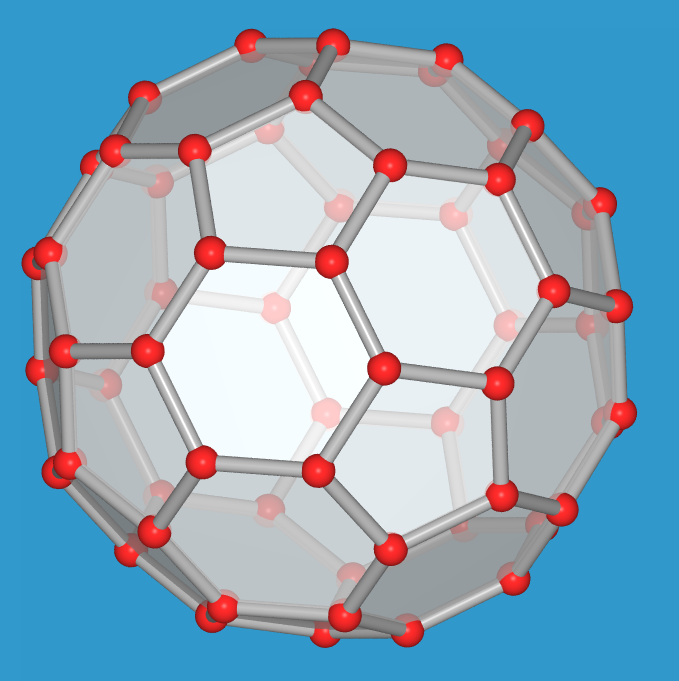
| hexagonaler Graphit | C60 | |
 |
 |
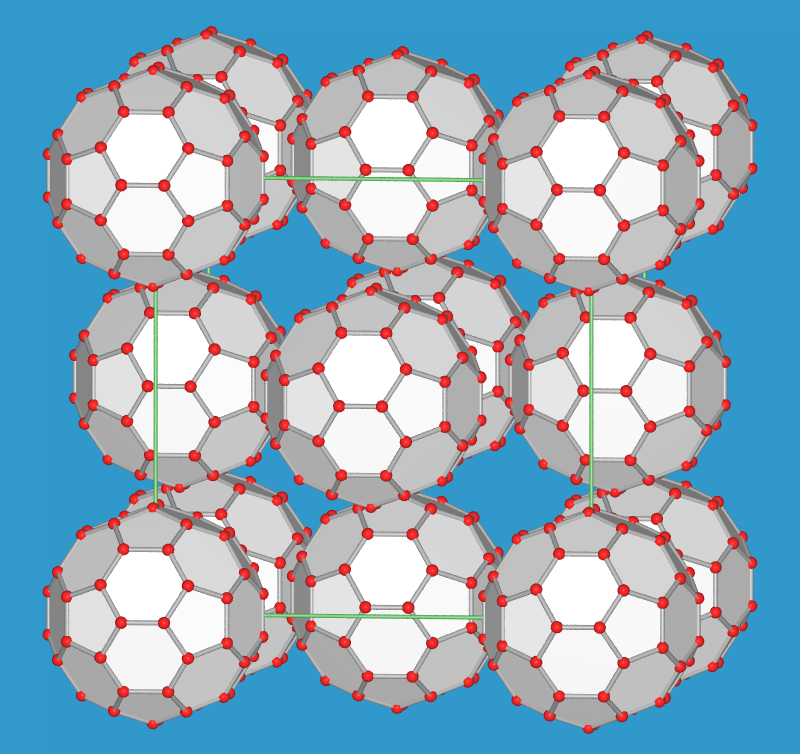 |
| hexagonale Form (s.a. ST-DB) | Molekül und ganze Zelle | |
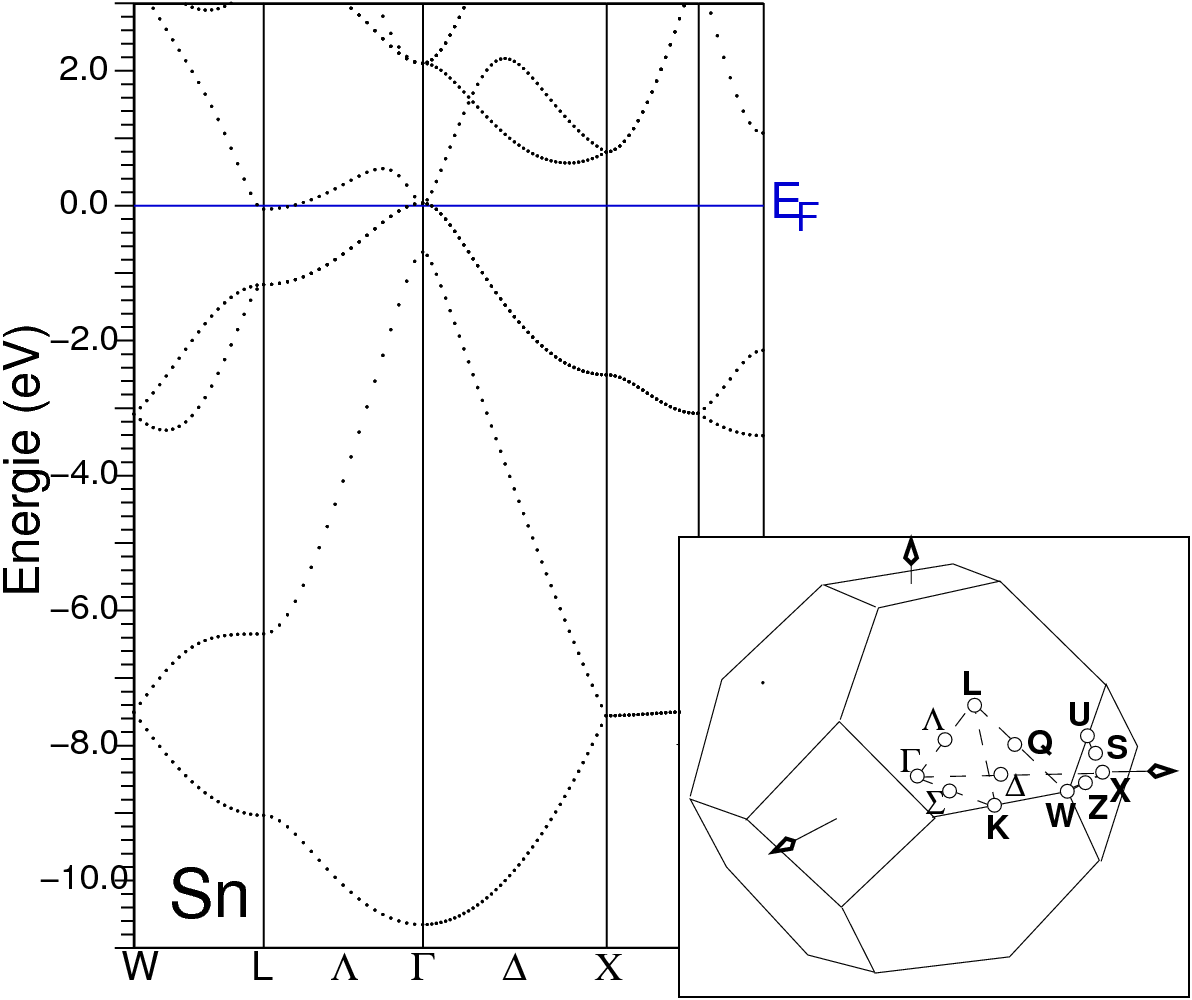 |
| Abb. 2.2.5.6. Bandstruktur von α-Sn ‣SVG |
Die Bandlücken der Elemente nehmen im Periodensystem von oben nach unten ab (s. Tab. 2.2.5.1), die reinen
Tetrele haben sogenannte indirekte Bandlücken, d.h. die Valenzbandoberkante ist nicht
am gleichen Punkt im k-Raum wie die Leitungsbandunterkante. Dadurch lassen sich elektronisch
keine optischen Übergänge auslösen (Impulserhaltung Photon -- Elektron, Anwendung von Silicium in
Solarzellen, jedoch nicht in LEDs). Die Abbildung 2.2.5.6. zeigt die Bandstruktur von grauem
Zinn entlang ausgezeichneter Pfade im k-Raum. Man sieht am Bandverlauf, dass es sich bei
dem unteren Valenzband um ein s-artiges, bei den oberen drei Bändern um p-artige
Zustände handelt. Insgesamt liegen vier Bänder unter dem Ferminiveau, die
(primitive!) Elementarzelle enthält zwei Atome und vier Einfachbindungen.
Bei Silicium und Germanium hat das Valenzband bei Δ sein Minimum, dadurch
entsteht eine indirekte Bandlücke.
Unter Druck bilden die drei Elemente diverse metallische Modifikationen. Die
metallische Form des elementaren Zinns, die bereits oberhalb von 13oC thermodynamisch stabil ist,
wird bei den besonderen Metall-Strukturen in Kapitel 3.2. behandelt.
| dX-X | Bandlücke | |
| [pm] | [eV] (bei O K) | |
| CDiamant | 154.5 | 5.4 (i) |
| CGraphit | 141.8/335 | 0 |
| C60 | 139/145 | |
| Si | 235.2 | 1.17 (i) |
| Ge | 245 | 0.744 (i) |
| α-Sn | 280 | 0 (d) |
Wieder ergeben sich die allgemeinen Tendenzen:
... und weiter mit den letzten Nichtmetall, dem Bor (Kap. 2.2.6.) ...
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |