 |
 |
 |
 |
| Abb. 2.2.2. Natrium | Abb. 2.2.3. Kalium | Abb. 2.2.4. Na/K-Legierung | |
 |
 |
||
| Abb. 2.2.1. Lithium | Abb. 2.2.5. Rubidium | Abb. 2.2.6. Caesium | |
| cr_home | Nichtmetalle | Strukturchemie | FK-Chemie | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Kap. 9 | Literatur | ⇨ |
Physikalische Eigenschaften
Bei den Elementen handelt es sich um weiche, weiße Metalle.
Sie weisen sehr große Atomradien und damit entsprechend niedrige Dichten auf.
Die Dichte von Lithium (Abb. 2.2.1) beträgt z.B. nur 0.54 g/cm3, auch Natrium (Abb. 2.2.2.) und Kalium (Abb. 2.2.3.)
schwimmen auf H2O.
Sie haben insgesamt sehr niedrige Schmelz- und Siedepunkte
(z.B. für die Schmelzpunkte: Li: 180oC,
Na: 98oC,
K: 63oC,
Rb: 40oC,
Cs: 28oC).
Na-K-Legierung der eutektischen Zusammensetzung ist auch bei Raumtemperatur flüssig (s. Abb. 2.2.4.)
und wird daher als Trockenmittel verwendet. Den Rekord für Metalle
bildet eine Na/K/Cs-Legierung mit einem Schmelzpunkt von nur -78 oC.
Natrium und Kalium werden üblicherweise unter Petroläther,
Rubidium und Caesium in Ampullen eingeschmolzen aufbewahrt.
 |
 |
 |
 |
| Abb. 2.2.2. Natrium | Abb. 2.2.3. Kalium | Abb. 2.2.4. Na/K-Legierung | |
 |
 |
||
| Abb. 2.2.1. Lithium | Abb. 2.2.5. Rubidium | Abb. 2.2.6. Caesium | |
Kristallstrukturen
Die Alkalimetalle kristallisieren alle in der kubisch innenzentrierten
Packung (b.c.c., W-Typ),
die Hochdruckmodifikationen bilden dagegen auch interessante Strukturfolgen mit
dichteren Packungsstrukturen (s. Kapitel 2.5.
der Vorlesung Intermetallische Phasen).
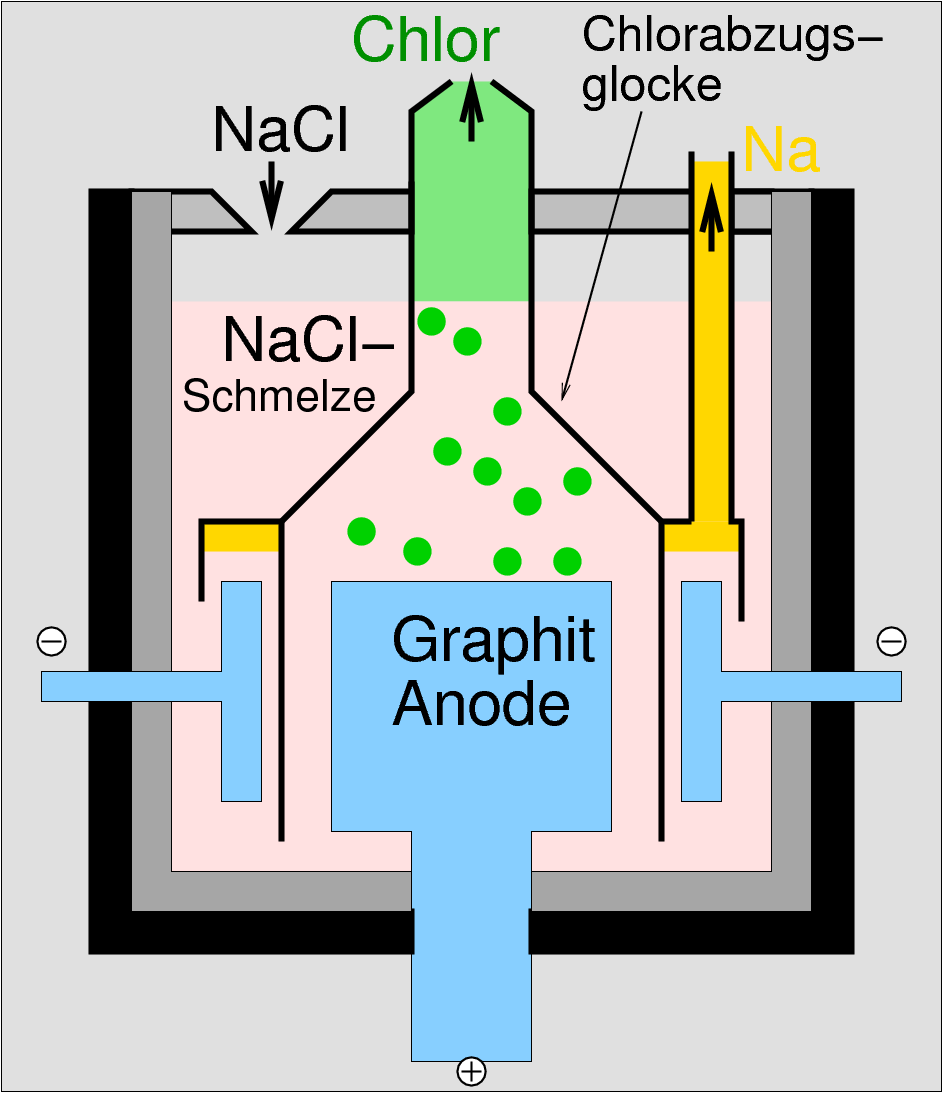
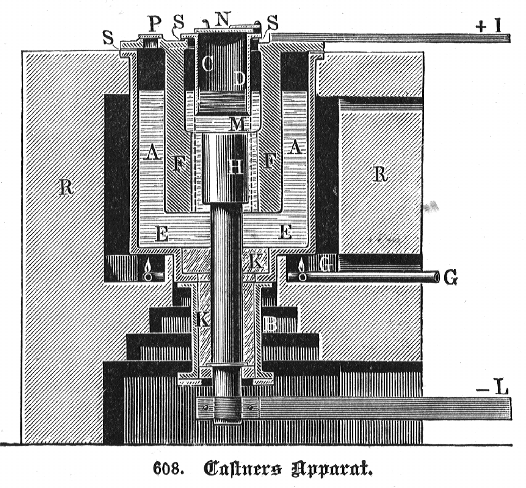
Die Darstellung der Elemente wird durch chemische oder durch elektrolytische Reduktion vorgenommen:
|  |

|
|
| Abb. 2.2.6. Downs-Zelle‣SVG (oben: Schemazeichnung; unten: Modell einer Zelle) | Abb. 2.2.7. Castner-Zelle (oben) mit Erläuterung einiger Buchstaben-Bezeichungen (unten). |
Verwendung
Die typische Reaktionen der Alkalimetalle sind fast ausschließlich die Oxidation des Metalls, z.B.
Zur Reaktion sehr kleiner Stückchen der ersten drei Elemente mit Wasser ... s. diese drei Videos:
| ⚗ Reaktion von Li, Na und K mit Wasser (Reaktivität, Schmelzpunkte, Dichten!) (23/40/13MB|MP4|H264) |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Kap. 9 | Literatur | ⇨ |
| cr_home | Nichtmetalle | Strukturchemie | FK-Chemie | Interm. Phasen | Oxide | Silicate | Strukturtypen |