Vorlesung Chemie der Metalle
1. Einleitung, Allgemeines
1.2. Abgrenzung Metalle - Nichtmetalle
Aus 'chemischer' Sicht sind Metalle die elektropositiven Elemente, die i.A. Kationen bilden.
Damit sind als Bindungstypen neben der metallischen vor allem die ionische und zusätzlich die
koordinative Bindung (mit ionischen und kovalenten Anteilen) wichtig.
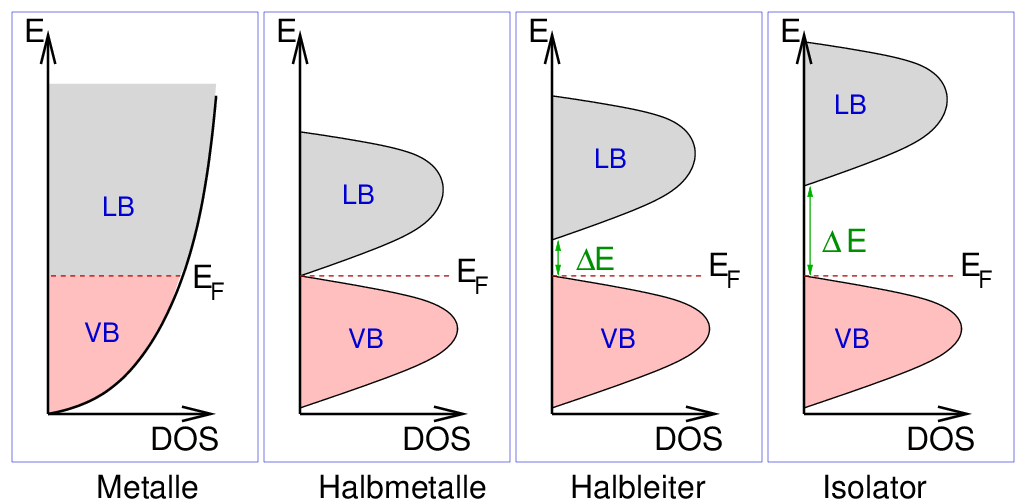
Als offensichtlichstes (s. Abb. 1.2.1.) Kennzeichen metallischer Elemente können
zunächst jedoch genannt werden:
- undurchsichtig, d.h. Absorption aller Wellenlängen des sichtbaren Lichts,
(Das alleine heisst zunächst nur, dass die Bandlücke kleiner als 1.5 eV ist).
- dabei aber 'metallisches' Aussehen, also metallischer Glanz der Oberfläche (s. Abb. 1.2.1.), d.h. Emission
von sichtbarem Licht aller Wellenlängen.
 |
 |
 |
| Natrium |
Magnesium |
Gallium |
 |
 |
 |
| Mangan |
Nickel |
Molybdän |
| Abb. 1.2.1. Fotos einiger typischer metallischer Elemente |
Weitere Eigenschaften von metallischen Elementen und Legierungen sind:
- duktil, dehnbar (extrem wichtige mechanische Eigenschaft für die Anwendung und Verarbeitung als
Material)
- gute Wärmeleitfähigkeit (nicht allein für Metalle spezifisch)
- gute elektronische Leitfähigkeit σ, d.h. geringer elektrischer
Widerstand ρ
Die Werte für die Leitfähigkeiten
(bzw. der elektrische Widerstand als
Kehrwert der Leitfähigkeit)
unterschieden sich bei Metallen und Nichtmetallen gravierend, wie Tab. 1.2.1. zeigt.
| Leiter |
Stoffklasse |
Substanz |
spezifischer elektr. Widerstand |
Bandlücke ΔE |
DOS bei EF |
| [Ω m] bei 25oC |
[eV] bei 0 K |
(s. Abb. 1.2.3) |
| 1. Klasse |
Metalle |
Cu |
1.7 * 10-8 |
keine |
gross |
| Li |
8.6 * 10-8 |
| Halbmetalle |
As |
3.5 * 10-7 |
0 |
klein |
| Bi |
1.2 * 10-6 |
| C (Graphit) |
0.8 * 10-5 |
| 2. Klasse |
Halbleiter |
Te |
2 * 10-3 |
0.33 |
0 |
| Si |
6.4 * 102 |
1.17 |
| Nichtmetalle |
Glas |
109 |
> 3 eV |
| S8 |
1015 |
2.61 eV |
| C (Diamant) |
1012 |
5.4 eV |
| NaCl |
? |
8.7 eV |
| Teflon |
1023 |
? |
Tab. 1.2.1. Elektrische Leitfähigkeiten ausgewählter Elemente
↪ VL 1.1. unten
Im Übrigen ist der metallische Zustand an kondensierte Stoffe (Flüssigkeiten oder Festkörper)
gebunden. Bei Metalldämpfen entfallen eine Reihe charakteristischer Eigenschaften von
Metallen.
Für die genaue Eingruppierung ist die
Temperaturabhängigkeit der elektrischen Leitfähigkeit σ maßgeblich. Danach unterschiedet man in:
- Leiter 1. Klasse (z.B. Metalle oder Halbmetalle), bei
denen eine Temperaturerhöhung zu einer Verringerung
der Leitfähigkeit, d.h. zu einer Erhöhung des elektrischen Widerstands, führt.
�F588;
| ⚗ Temperaturabhängigkeit der Leitfähigkeit von Kupfer
(18MB|MP4|H264) |
|
|
Gemäß U=RI fliesst bei einer bestimmten an den Cu-Draht angelegten
Spannung U ein Strom I. Wegen R = ρ l/A haben wir den Draht lang (grosses l) und
dünn (kleine Fläche A) gewählt, um einen kompletten Kurzschluss zu vermeiden.
Der spezifische elektrische Widerstand ρ hat wegen ρ = R A/l die Einheit [Ω m].
Der direkte Kehrwert ist die spezifische elektrische Leitfähigkeit σ in [Ω-1 m-1].
Beim Abkühlen des Drahtes steigt die Stromstärke (bei gleicher angelegter Spannung),
der elektrische Widerstand verringert sich also bei Temperaturerniedrigung.
|
- Leiter 2. Klasse (z.B. Isolatoren oder Halbleiter), bei
denen genau die umgekehrten Effekte auftreten. Mit der Temperatur
nimmt die Leitfähigkeit zu, der Widerstand entsprechend ab.
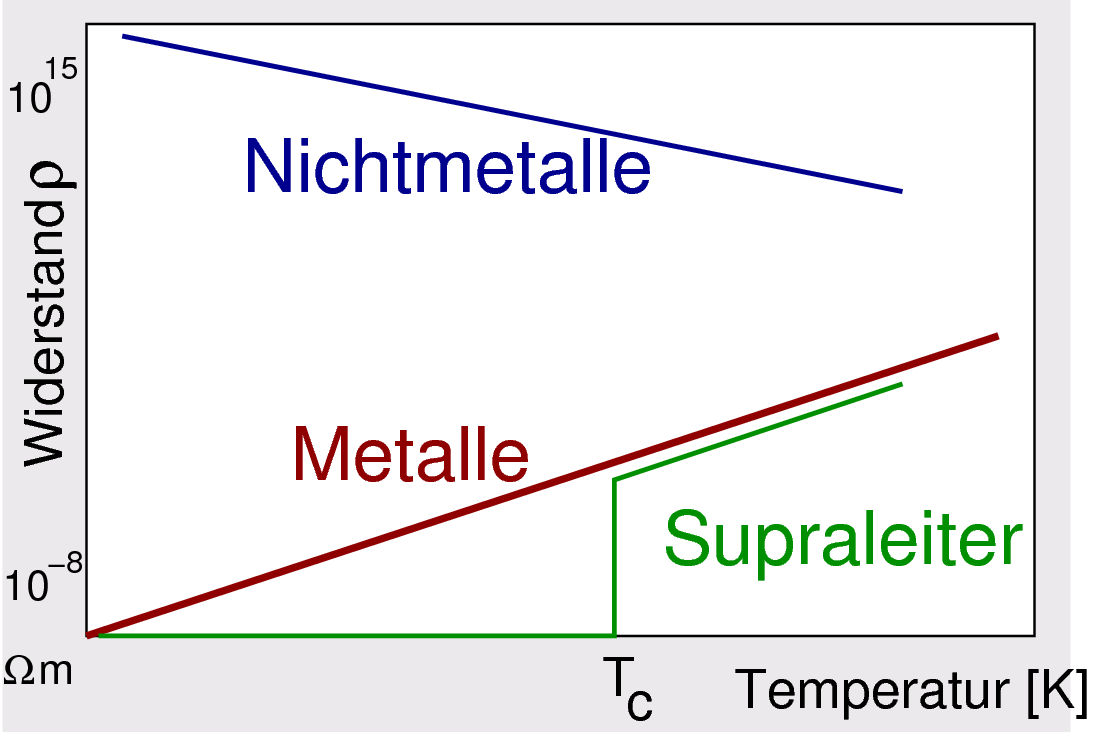 |
| Abb. 1.2.2. Temperaturabhängigkeit des elektrischen Widerstands ρ
‣SVG
|
Die obenstehende Abbildung 1.2.2. zeigt den typischen Verlauf des elektrischen
Widerstands für die beiden Leiterklassen sowie den von Supraleitern.
| ⚗ Meissner-Ochsenfeld-Effekt (Dauermagnet über 1-2-3-Supraleiter,
YBa2Cu3O7-x fliegen lassen)
(2.5MB|MP4|H264) |
|
|
Der Meissner-Ochsenfeld-Effekt basiert auf der Eigenschaft der Supraleiter, dass sie
perfekte Diamagnete sind, also kein Magnetfeld im Innern aufweisen. Diese Eigenschaft wiederum
läßt sich durch einen vom äußeren Magnetfeld induzierten Ringstrom verstehen,
der einige 100 Angström in die Oberfläche des Materials eindringt.
Und HIER noch eine Steigerung von dem ganzen!
|
Zur Erklärung dieser Abhängigkeit ist wichtig, dass die elektronische Leitfähigkeit
neben der Elementarladung der Elektronen (e), von der Zahl der Ladungsträger (N) und
deren Beweglichkeit (B) bestimmt wird:
σ = e N B
- Bei den Leitern 1. Klasse (d.h. bei Metallen und Halbmetallen)
bleibt die Zahl der Ladungsträger gleich und hoch, es
kommt aber bei Erhöhung der Temperatur zu einer stärkeren Bewegung der
Atomrümpfe und dadurch zu einem höheren Widerstand.
Entscheidend ist hier also die Abnahme der Beweglichkeit der Ladungsträger mit
steigender Temperatur.
- Bei Nichtmetallen und Halbleitern, d.h. bei den Leitern 2. Klasse,
werden dagegen bei höherer Temperatur erst mehr Elektronen aus den Atomrümpfen freigesetzt,
d.h. hier kommt es zu einer Zunahme der Zahl der Ladungsträger mit steigender Temperatur.
Die Gruppierung in Metalle und Nichtmetalle aus bindungstheoretischer Sicht
ist ebenfalls möglich. Der Unterschied ist
der energetische Abstand zwischen besetzten und unbesetzten elektronischen Zuständen
im Festkörper. Dieser Abstand entspricht den vom MO-Modell der Molekülchemie
bekannten HOMO-LUMO-Abstand. Molekülverbindungen sind damit Nichtmetalle.
Im Bänder-Modell des Festkörper entspricht er der Bandlücke, d.h. dem
energetischen Abstand zwischen Valenzband und Leitungsband. Danach lassen sich
wieder die beiden Leiterklasse unterscheiden
(Erinnerung zu Energie-Einheiten: 1 eV = 100 kJ/mol; RT = 0.025 eV = 2.5 kJ/mol)
- Leiter 2. Klasse:
- ΔE > 3 eV: Nichtleiter (Isolatoren)
- ΔE von ca. 1.5 bis 3 eV: farbige Stoffe (z.B. Sulfide, Isolatoren)
- ΔE von ca. 0.5 bis 1.5 eV: klassische Halbleiter
- Leiter 1. Klasse:
- keine Bandlücke ΔE (Richtmaß wie immer: RT=0.025 eV bei Raumtemperatur!) Halbmetalle und Metalle
Die Grenze zwischen Metallen und Halbmetallen läßt sich nur
über die Zustandsdichte am Ferminiveau (s. Tab. 1.2.1, Abb. 1.2.3. und Kap. 1.3.)
festlegen. Die Halbmetalle haben ein sehr deutliches Minimum am Ferminiveau, d.h. die Zustandsdichte
ist dort deutlich kleiner (bei T = 0 K: DOS(EF) = 0) als bei den echten Metallen.
Bezüglich der optischen Eigenschaften (s.o.) folgt unmittelbar, dass
Stoffe mit Bandlücken zwischen ca. 1.5 und 3 eV (150 bis 300 kJ/mol)
farbig (gelb bis schwarz), alle mit kleineren Bandlücken schwarz oder metallisch glänzend sind.
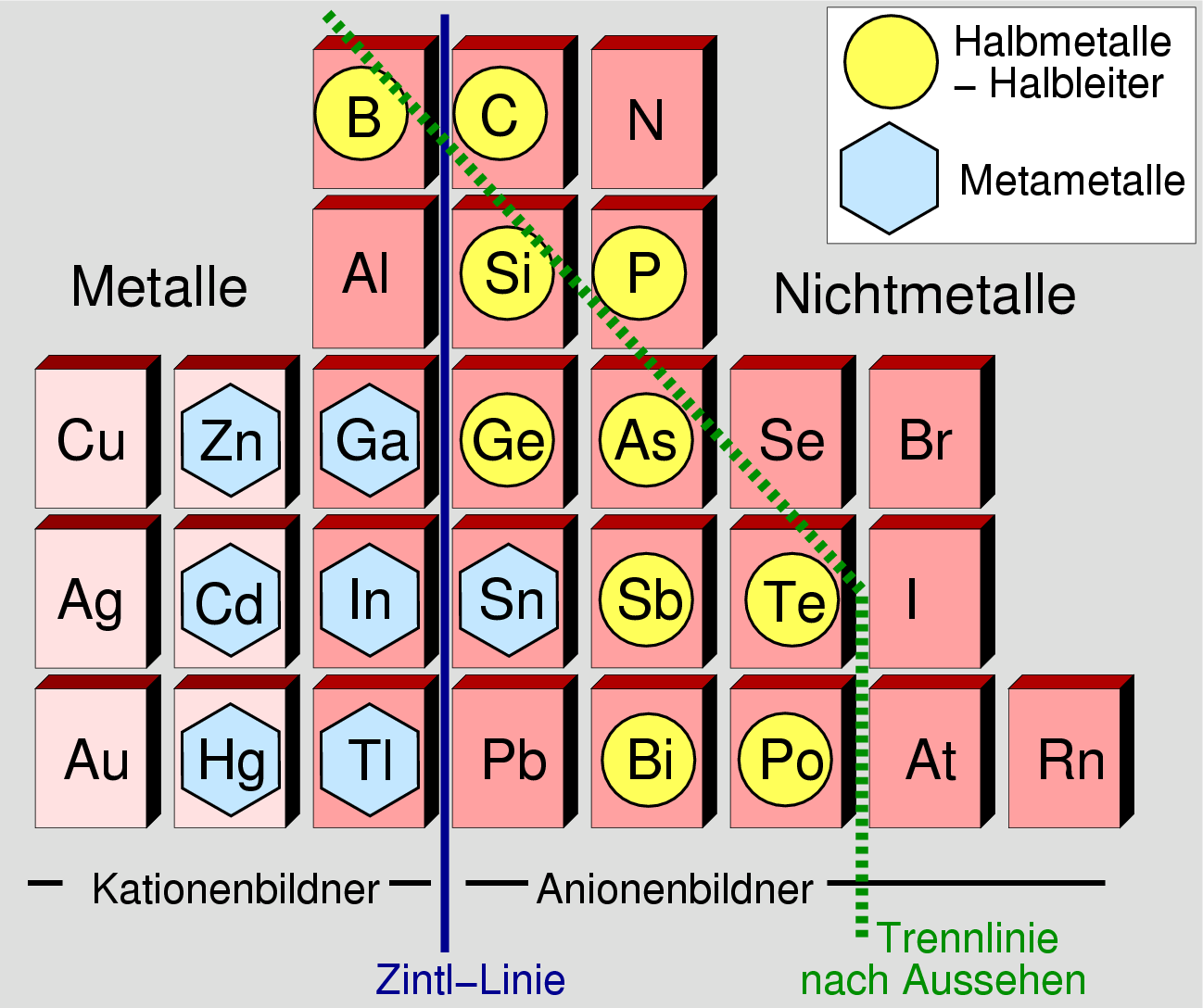
Die Grenze zwischen Metallen und Nichtmetalle
im Periodensystem
ist ebenfalls nicht ganz eindeutig zu ziehen. Eine Reihe von Elementen
an der Grenze zwischen Metallen und Nichtmetallen bildet
zusätzlich mehrere Modifikationen mit unterschiedlichen elektrischen Eigenschaften:
Einige Punkte zur Erläuterung der Grenze Metalle - Nichtmetalle in Abbildung 1.2.4.:
- Die Elemente der Nebengruppen (d-Block) sind hellrosa, die Elemente der Hauptgruppe (p-Block)
hellrot gekennzeichnet. Alle Elemente links des gezeigten Ausschnitts sind
echte Metalle, alle Elemente rechts echte Nichtmetalle!
- Die grün eingezeichnete Linie bezeichnet eine Grenze nach Aussehen
der Elemente. Kritisch wird die Einstufung z.B. bei Kohlenstoff
(Graphit und Diamant als Polymorphe) oder bei Bi (extrem kleine Bandlücke).
- Gelegentlich werden auch noch weiter unterschieden:
- Aluminium und Blei liegen als echte Metalle mitten im Übergangsbereich!
- 'Meta'-Metalle (in Abb. 1.2.4. durch blaue Sechsecke gekennzeichnet, auch B1-Elemente)
bilden die Übergangsglieder zwischen echten Metallen (A1 und A2) und Halbmetallen/Halbleitern (B2).
Diese B1-Elemente haben besondere, meist von echten Metallpackungen
durch Verzerrung abgeleitete Strukturen. Physikalisch handelt es sich um
echte Metalle, d.h. Leiter 1. Klasse ohne Bandlücke.
- Halbmetalle/Halbleiter (hier durch gelbe Kreise gekennzeichnet, B2-Elemente) sind
spröde und dehnen sich beim Erwärmen aus. Sie haben überwiegend
kovalente Strukturen (die 8-N-Regel ist erfüllt), sehen aber wegen
der kleinen Bandlücke unterhalb von 1.5 eV metallisch
aus.
- Als 'chemische' Trennung zwischen Metallen (d.h. Kationenbildnern) und
Nichtmetallen (d.h. Anionenbildnern) kann die sogenannte 'Zintl-Linie'
(oben als blaue Linie zwischen der III. und der IV. Hauptgruppe eingezeichnet)
angesehen werden. Allerdings gilt auch diese Grenze nicht streng, wie die von
Eduard Zintl (von 1928 bis 1933 HIER)
selber dargestellte, charakterisierte und korrekt beschriebene Verbindung NaTl (‣VRML) belegt, in der ein Diamant-analoger
Tl--Anionenverband vorliegt.
- Als Grenze für die Vorlesungen Metalle und Nichtmetalle
wird etwas willkürlich die in Abbildung 1.2.5. grün eingezeichnete Linie verwendet:
Hieraus folgt für das weitere Vorgehen in der Vorlesung Chemie der Metalle (Inhaltsübersicht):
- Kap. 1: Einleitung: mit
Strukturen und Bindung in elementaren Metallen
- Kap. 2 bis 6: Metallische Elemente der Hauptgruppen, nach Gruppen
geordnet. Zu jeder Gruppe werden die Elemente
(Vorkommen, Gewinnung, Nachweis) und die
wichtigsten/einfachen Verbindungen (Halogenide, Oxide, ...)
diskutiert. Bei den Halogeniden erfolgt jeweils die Einführung
in salzartige Strukturen (Ionenkristalle)
der Zusammensetzungen AX, AX2,
AX3 usw.
- Kap. 2 und 3: Alkali- und Erdalkali-Metalle
- Kap. 4: Elemente der III. Hauptgruppe (Triele) ab Aluminium
- Kap. 5: Elemente der IV. Hauptgruppe (Tetrele), und zwar nur Germanium,
Zinn und Blei
- Kap. 6: Elemente der V. Hauptgruppe (Pentele), nur Antimon und Bismut
- Kap. 7: Lanthanoide und Actinoide
- Kap. 8: Übergangsmetalle, weiter untergliedert
nach Verbindungsgruppen:
Wie bereits in der Einleitung angedeutet, werden viele Dinge
aus den ersten Semestern nochmals kurz wiederholt bzw. vorausgesetzt.
Wirklich neu sind vor allem Aspekte der technisch wichtigen Verfahren,
die Strukturchemie von Metallen und Ionenkristallen und die entsprechenden
Bindungskonzepte. Auch die Koordinationschemie ist ein wichtiges Teilgebiet
der Chemie der Metalle. Viele Metallverbindungen haben sehr interessante
Eigenschaften und sind daher für Anwendungen hochaktuell (Magnetismus,
optische Eigenschaften, Homogenkatalysatoren, elektronische und Supra-Leiter, Thermoelektrika,
Piezoelektrika usw.). Diese Eigenschaften werden im MSc. im Detail besprochen
und hier meist nur kurz angedeutet.
Für alle Metalle gemeinsam sind noch die folgenden beiden Teilkapitel: