Vorlesung Chemie der Metalle
8. Übergangsmetalle
8.2. Elementare Metalle
8.2.1. Eigenschaften
Viele physikalische Eigenschaften der reinen Metalle
sind nur graduell unterschiedlich:
- Alle Übergangsmetalle sind gute elektronische Leiter (1. Klasse) und Wärmeleiter
(Wiedemann-Franz'sches Gesetz).
- Sie zeigen silber-metallischen (selten goldenen) Glanz, der im Detail von Oberflächen und/oder
von der elektronischen Struktur bestimmt wird.
Die Abbildung 8.2.2. zeigt Fotos einiger Übergangsmetalle.
 |
 |
 |
 |
| Titan |
Vanadium |
Chrom |
Mangan |
|
 |
 |
 |
 |
| Cobalt |
Nickel |
Kupfer |
Zink |
|
 |
 |
| Silber |
Cadmium |
| Abb. 8.2.2. Fotos einiger Übergangsmetalle
|
- Viele der Übergangsmetalle und ihre Legierungen sind wichtige
mechanische Werkstoffe
(z.B. Fe, Ni, Cr, Mn, Cu, Zn, Ag, Mo, W). Je nach Element lassen sie
sich hervorragend verarbeiten, umformen (Walzen, Ziehen, Giessen, etc.),
spanend verarbeiten, verbinden (Löten, Schweissen) etc. etc.
- Die Eigenschaften sind besonders deswegen interessant und vielfältig bei Anwendungen
eingesetzt, weil sich die meisten Übergangsmetalle über weitere
Zusammensetzungsbereiche ineinander lösen bzw. die
intermetallischen
Phasen große Phasenbreiten zeigen und damit die Eigenschaften weiter (gezielt)
eingestellt und variiert werden können (Stähle, Messing, Bronzen, usw. usw.).
- Einige Metalle sind wertvolle Edelmetalle (Ag, Au, Pt) oder
Heterogenkatalysatoren, andere (z.B. La) sind dagegen sehr unedel (s.u. zu den Redoxpotentialen).
- Bis auf die Elemente Zn, Cd und Hg weisen sie recht hohe bis sehr hohe Schmelzpunkte auf (s.u.)
- Sie kristallisieren bis auf wenige Ausnahmen (z.B. Mn) in einfachen
dichten Kugelpackungen.
Die Strukturen (s.u.) bestimmen sehr wesentlich die mechanischen Eigenschaften.
- Einige Metalle haben zusätzlich interessante physikalische Eigenschaften. So sind
Eisen, Cobalt und Nickel z.B. ferromagnetisch. Andere Metalle oder Legierungen
sind bei tiefen Temperaturen Supraleiter.
Abbildung 8.2.1. fasst viele Eigenschaften der Elemente sowie Vorkommen, Gewinnung etc. zusammen.
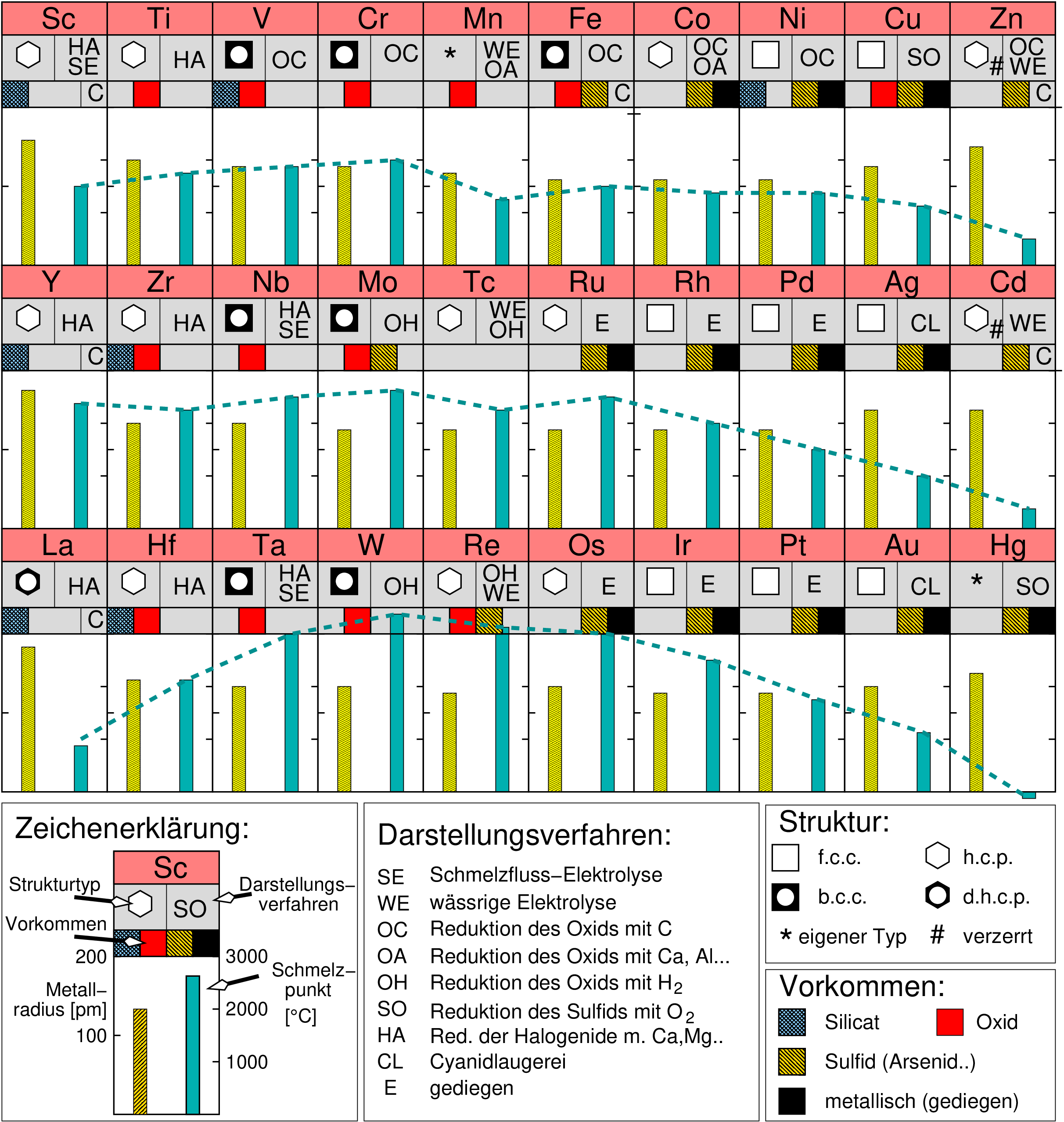 |
| Abb. 8.2.1. Übersicht zu Struktur, Vorkommen, Gewinnung
sowie Schmelzpunkte der Übergangsmetalle
‣SVG
|
Chemische Beständigkeit: Redoxpotentiale
Die Redoxpotentiale bestimmen die chemischen Eigenschaften, z.B. die
Beständigkeit an Luft etc.
Die Übergangsmetalle sind, wie Tabelle 8.2.1. zeigt, insgesamt edler als die
s- und p-Blockmetalle, zu ihnen gehören mit Gold, Platin etc. die
edelsten Metalle überhaupt und diese finden entsprechend Anwendung (inerte Tiegelmaterialien,
inerte Elektrodenmaterialien, Schmuck, Materialien in der Medizin etc.).
Da viele Metalle mehrere Oxidationsstufen ausbilden, sind auch diese Unterschiede
sowie die Redoxpotentiale zwischen den verschiedenen Oxidationsstufen zu beachten (s. Kap. 8.1.,
z.B. auch pH-Abhängigkeit in Pourbaix- und Frost-Diagramme).
Für sie genauen Werte und den Verlauf im Periodensystem
ergibt sich insgesamt ein uneinheitliches Bild:
In den meisten Nebengruppen steigt der edle Charakter mit der Ordnungszahl
(Au ist edler als Cu, Hg edler als Zn usw.).
Nur bei den Elemente in der III. und IV. Nebengruppe liegt der umgekehrte Trend vor, beispielsweise
ist Titan edler als Hafnium und Scandium edler als Lanthan. Tabelle 8.2.1. enthält einige
wichtige Redoxpotentiale der Übergangsmetalle (rot unterlegt), im Vergleich mit denen von Nichtmetallen und Hauptgruppenmetallen
(z.B. die Reihe Cu-Ag-Au oder Zn-Cd-Hg).
Neben den Redoxpotentialen ist für die chemische Stabilität der Elemente natürlich
auch wieder wichtig,
ob eine (Oxid/Hydroxid)-Deckschicht entsteht bzw. wie diese beschaffen ist.
| Element |
oxidiert |
|
reduziert |
E [V] |
| Fluor (F) | F2 | + 2e- ⟶ | 2 F- | +2.87 V |
| Sauerstoff | H2O2 + 2 H3O+ | + 2e- ⟶ | 4 H2O | +1.78 |
| Gold (Au) | Au+ | + e- ⟶ | Au | +1.69 V |
| Au3+ | + 3e- ⟶ | Au | +1.50 V |
| Au3+ | + 2e- ⟶ | Au+ | +1.40 V |
| Chlor (Cl) | Cl2 | + 2e- ⟶ | 2Cl- | +1.36 V |
| Brom (Br) | Br2 | + 2e- ⟶ | 2Br- | +1.07 V |
| Silber (Ag) | Ag+ | + e- ⟶ | Ag | +0.80 V |
| Eisen (Fe) | Fe3+ | + e- ⟶ | Fe2+ | +0.77 V |
| Iod (I) | I2 | + 2e- ⟶ | 2I- | +0.53 V |
| Kupfer (Cu)
| Cu+ | + e- ⟶ | Cu | +0.52 V |
| Cu2+ | + 2e- ⟶ | Cu | +0.34 V |
| Cu2+ | + e- ⟶ | Cu+ | +0.16 V |
| Wasserstoff (H) | 2H+ | + 2e- ⟶ | H2 | 0 V |
| Cadmium (Cd) | Cd2+ | + 2e- ⟶ | Cd | -0.40 V |
| Eisen (Fe) | Fe2+ | + 2e- ⟶ | Fe | -0.45 V |
| Zink (Zn) | Zn2+ | + 2e- ⟶ | Zn | -0.76 V |
| Wasserstoff (H) | 2 H2O | + 2e- ⟶ | H2 + 2 OH- | -0.83 V |
| Aluminium (Al) | Al3+ | + 3e- ⟶ | Al | -1.66 V |
| Lithium (Li) | Li+ | + e- ⟶ | Li | -3.04 V |
| Tab. 8.2.1. Standardpotentiale ausgewählter Redoxpaare
(knallig unterlegt: Übergangsmetalle)
|
Schmelzpunkte und Atomradien
Die Schmelzpunkte der Übergangsmetalle
zeigen einen umgekehrten Verlauf zum typischen Gang der Atomradien (gelbe
Balken in Abb. 8.2.1.):
Die Atomradien von Mn, Tc und Re, d.h. den Elementen in der Mitte jeder d-Reihe, sind
am kleinsten (und ein nettes VRML dazu).
Erklärungen dieser Gänge in den Atomradien (und damit der Schmelzpunkte)
erfordern die vollständige Beschreibung der elektronischen Strukturen
der Metalle, aus denen ja die Atomradien = Metallradien ermittelt werden.
Hierbei ist vor allem zu beachten, dass die ns- und np-Zustände gemeinsam
Bänder hoher Dispersion ausbilden, und sich die (n-1)d-Zustände
mit der Valenzelektronenkonzentration innerhalb dieses Bandbereiches verschieben und sich
ihre Dispersion in der Mitte der Übergangsreihe deutlich ändert!
Eine grobe Erklärung hierzu gibt es im
Kap. 8.1. (inkl. Abb. 8.1.3 (SVG))
und dann vollständiger im
Kapitel 2.1. der Vorlesung Intermetallische Phasen.
Einfache Erklärungen auf reiner Atombasis funktionieren NICHT!
Umgekehrt zum Gang der Atomradien verhält sich
der Gang der Schmelzpunkte bzw. auch der Siedepunkte (cyane Balken):
In jeder Periode liegt das Maximum bei etwa der Hälfte der Elemente, d.h. bei Chrom, Molybdän und Wolfram (6. Nebengruppe).
Nach vorne und hinten zu nehmen Schmelz- und Siedepunkte wieder ab.
Am Anfang und am Ende der Nebengruppenelemente fallen die Schmelzpunkte von
oben nach unten (z.B. in der Reihe Sc - Y - La oder noch bekannter in der Reihe Zn - Cd - Hg) .
Mechanische Eigenschaften und Strukturen
Die Strukturen aller Metalle (bis auf Mangan) gehören
zu den einfachsten Strukturtypen der Metalle
(vgl. Kap. 1.4. und die Abb. 1.4.1 dazu).
Verglichen mit den Alkali- und Erdalkalimetallen sind die Übergangsmetalle
zwar deutlich härter, die Details der mechanischen Eigenschaften
hängen jedoch vom Strukturtyp ab: Die im f.c.c.-Typ kristallisierenden Elemente
(z.B. Kupfer) sind vergleichsweise duktil (viele Gleitsysteme), b.c.c.-Metalle dagegen
sind meist hart und spröde (z. B. Eisen oder Chrom). Metalle mit h.c.p.-Struktur
liegen meist dazwischen.
Genaueres hierzu gibt es im
Kapitel 1.2.: Realkristalle (bei den Linienfehlern) in der
Festkörperchemie-Vorlesung.
- Die Elemente der Sc- und Ti-Gruppe kristallisieren in der hexagonal dichten Kugelpackung.
- Alle Elemente der Vanadium- und Chrom-Gruppe kristallisieren kubisch innenzentriert.
Die Elemente sind hart und nicht duktil.
- Mangan bildet drei verschiedene kubische, recht komplexe Strukturen.
(s. genauere zu den Strukturen von Mangan im Kap. 2.5.
der Vorlesung Intermetallische Phasen).
Tc und Re kristallisieren wieder in der einfachen hexganal dichten Kugelpackung (h.c.p.).
- Beim Eisen, das bei Raumtemperatur eine b.c.c.-Packung aufweist, liegt eine interessante
und wichtige Polymorphie vor:
b.c.c. (α-Fe) ⟶ 906oC ⟶ f.c.c. (γ-Fe) ⟶ 1401oC ⟶ b.c.c. (δ-Fe)
β-Fe ist die Modifikation, die keinen Ferromagnetismus mehr zeigt.
Eisen ist aufgrund der b.c.c.-Struktur nicht duktil!
- Die drei ferromagnetischen Nachbarelemente Eisen (b.c.c.), Cobalt (h.c.p.) und Nickel (f.c.c.)
haben die drei unterschiedlichen Metallstrukturen.
- Alle Pt-Metalle kristallisieren wie Kupfer, Silber und Gold im
f.c.c.-Gitter (Cu-Typ).
Diese Elemente sind relativ weich/duktil (z.B. lassen sich Kupfer, Silber
und Gold sehr dünn walzen).
- Zink und Cadmium kristallisieren verzerrt hexagonal dicht und sind
wieder deutlich härter (z.B. Zink-Giesskannen oder -Wannen).
- Quecksilber ist speziell (bei Raumtemperatur flüssig!) und kristallisiert beim
Abkühlen in einem eigenen (aber recht einfachen) Strukturtyp.
(Genaueres zur Struktur s. Kapitel 2.4.
der Vorlesung Intermetallische Phasen).
8.2.2. Vorkommen
Auch bei den Vorkommen der Elemente (s. Abb. 8.2.1. sowie
wieder das ‣SVG zu Elementhäufigkeiten in der Lithosphäre) gibt es eine gewisse Kontinuität.
Einerseits sind natürlich die auftretenden Oxidationsstufen (s. Kap. 8.1.) wichtig,
andererseits kann das HSAB-Konzept genutzt werden, um z.B. überwiegend oxidische (hart-hart) von
überwiegend sulfidischen (weich-weich) zu unterscheiden. Auch die Tatsache, dass nur die edelsten
der Metalle auch gediegen vorkommen, ist wenig überraschend. Im Einzelnen (nach dem PSE von links nach rechts):
- Die Elemente der Sc-Gruppe kommen als Silicate und Carbonate (wie auch die Lanthanoide) vor
(blaue Markierung).
- Bei den Elementen der Ti- bis zur Mn-Gruppe dominiert das Vorkommen in Form von Oxiden
(rote Markierung). Insbesondere
bei den vierwertigen Metallionen dominiert der Rutil-Typ.
Die schwereren Elemente dieser Gruppen (z.B. Mo oder Re) kommen zunehmend auch als
Sulfide vor (gelbe Markierung).
Elemente, bei denen die hohen Oxidationsstufen stabil sind, gibt
es auch in Form der entsprechenden Oxido-Salze. Dazu gehören z.B.
Scheelit (CaWO4), Vanadinit (Pb5(VO4)3Cl) oder Columbit (FeNb2O6).
- Bei den Fe-Metallen kommt Eisen selber als Sulfid, Oxid oder Carbonat, Cobalt und Nickel
vor allem als Sulfid, aber auch gediegen (schwarze Markierung) vor.
- Alle Pt-Metalle und die Münzmetalle (Cu, Ag und Au) sowie Hg kommen
entweder gediegen (da sie edel sind) oder als Sulfide vor, Kupfer auch als Oxid.
- Die deutlich unedleren Elemente Zink und Cadmium kommen in der Natur dagegen wieder
überwiegend in Form ihrer Sulfide oder Carbonate vor.
Die Abbildung 8.2.3. zeigt Fotos einiger Übergangsmetall-haltiger Erze, geordnet nach
chemischen Kriterien/Salz-Typen:
 |
 |
 |
| Molybdänglanz, MoS2 |
Kupferkies, CuFeS2 |
Pyrit, FeS2 |
 |
 |
 |
| Zinnober, HgS (rot) |
Zinkblende, ZnS (schwarz) |
Nickelin, NiAs |
| Sechs Beispiel für Vorkommen als Sulfide (Kiese, Glanze, Blenden)
|
 |
 |
 |
| Azurit, Malachit (Basische Cu-Carbonate) |
Himbeerspat (MnCO3) |
Bastnäsit
(LnFCO3) |
| Drei Beispiele für Vorkommen als Silicate, Carbonate ('Spat'), Phosphate etc.
|
 |
 |
 |
| Roteisenstein, Fe2O3 |
Magneteisenstein, Fe3O4 |
Cuprit, Cu2O |
 |
 |
 |
| Pyrolusit, MnO2 |
Hausmannit, Mn3O4 |
Rutil, TiO2 (kleinerer Kristall, ca 1 cm) |
| Sechs Beispiele für Vorkommen als einfache Oxide
|
 |
 |
 |
| Scheelit, CaWO4 |
Vanadinit, Pb5(VO4)3Cl |
Fe-Columbit, FeIINbV2O6 (Hagendorf,
Oberpfalz)
(schwarzglänzend) |
| Drei Beispiele für Vorkommen als Oxidometallate (nur Metalle in hohen Oxidationsstufen)
|
 |
 |
 |
| Gold |
Kupfer (Kristalle, Rudnyi, Russland) |
Eisen (Meteorit, Sikhote-Alin, Russland, 1947) |
| Drei Beispiele für Vorkommen als reine Metalle ('gediegen')
|
| Abb. 8.2.3. Erze/Rohstoffe für die Gewinnung einiger Übergangsmetalle (nach Verbindungsklassen)
|
8.2.3. Herstellung (Übersicht)
In der obigen Übersicht (Abb. 8.2.1.)
sind auch die Darstellungsverfahren für die einzelnen Übergangsmetalle mit aufgeführt, die
sich selbstverständlich zunächst nach dem Rohstoff (vorkommendem Mineral/Erz) richten.
Neben den eigentlichen Reduktionen sind vor allem auch Trenn- und Reinigungsschritte bei
der Gewinnung der reinen Elemente wichtig.
Die verschiedenen Reduktionsverfahren (und jeweils ein Beispiel) sind (nach Abb. 8.2.1. und mit den
dort verwendeten Abkürzungen):
Bei den Übergangsmetallen werden nur selten elektrochemische Reduktionsverfahren
(technische Gewinnungs-Elektrolysen) verwendet:
- Durch Schmelzflußelektrolyse (SE)
werden z.B. Scandium, Niob und Tantal hergestellt. Hierbei wird z.B. zur
Herstellung von elementarem Tantal eine Schmelzflußelektrolyse von K2[TaF7]
durchgeführt. Dieses wird durch Aufschluß der Erze
(z.B. Tantalit FeTa2O6) mit konzentrierter Flußsäure und
anschließende Trennung der Salze (vgl. Ähnlichkeiten von Nb und Ta aufgrund der Lanthanoiden-Kontraktion)
durch fraktionierte Kristallisation oder Extraktion hergestellt.
Bei dem umgangssprachlich als 'Coltan' bezeichneten 'kritischen' Mineral
handelt es sich um die Mischkristallreihe
Columbit FeNb2O6 (s. Foto in Abb. 8.2.3.) --
Tantalit FeTa2O6.
Ebenfalls bei Nebengruppenelementen nur selten angewendet wird die
- Elektrolyse der wässrigen Lösungen (WE).
Verfahren dieser Art sind für Zink, Cadmium und Mangan in Gebrauch, die zweiwertige
Ionen bilden, die in wässriger Lösung als einfache Hexaaquakomplexe vorliegen. Zur
Herstellung von elementarem Zink wird die geröstete Zinkblende (ZnS) in H2SO4 gelöst
und anschließend eine Elektrolyse der Sulfatlösung durchgeführt.
Im Handel laufen die auf diese Weise erhaltenen Metalle als Elektrolyt-Zink bzw. -Cadmium.
Die Gewinnung aus Schmelzen und durch Hochtemperaturreduktionen wird i.A. als
pyrometallurgische Gewinnnung bezeichnet.
Die häufigste, da billigste Methode für alle Metalle, die keine Carbide bilden, ist die Reduktion
der Oxide (O) mit elementarem Kohlenstoff (OC).
Auch Reduktionen der Oxide mit unedlen Metallen wie Aluminium (OA) oder mit Wasserstoff (OH) sind noch
häufig eingesetzte Verfahren:
- Die Reduktion der Oxide mit Kohlenstoff (OC)
ist von der Eisenherstellung (s. Kap. 9.8.) her sehr bekannt.
Vergleichbare Verfahren werden für
die 3d-Metalle von Vanadium bis Zink verwendet.
- Für Metalle, die Carbide bilden, wird die Reduktion mit unedleren Metallen (OA)
(z.B. die aluminothermische Reduktion) verwendet. Beispiele sind die Herstellung
von Mangan aus Hausmannit:
3 Mn3O4 (Hausmannit) + 6 Al ⟶ 9 Mn + 4 Al2O3
oder die Herstellung von Cobalt. Die Verfahren sind natürlich deutlich teurer als die Reduktion mit Kohlenstoff.
- Für Elemente, die sowohl Carbide als auch intermetallische Phasen mit Aluminium bilden,
muß die teure Reduktion mit H2 (OH) eingesetzt werden.
Dieses Verfahren ist nur für die Herstellung von Molybdän und Wolfram erforderlich.
Z.B. erfolgt die Herstellung von Wolfram durch Reduktion von WO3 mit Wasserstoff:
CaWO4 + Na2CO3 ⟶ Na2WO4 ⟶ + H+ ⟶ WO3 ⟶ +H2
⟶ W
Die drei zuletzt genannten Verfahren werden für die Reduktion der Oxide verwendet. Dagegen gibt es
für die edleren, in Form ihrer Sulfide vorkommenden Elemente, ein trickreiches Verfahren, wo die
Reduktion mit Sauerstoff (!) bewerkstelligt wird:
- Die Reduktion der Sulfide mit O2 (SO)
wird für die Gewinnung von Quecksilber aus Zinnober (HgS) und von Cu aus den Sulfiden
(s. Kapitel 9.1 im Detail)
eingesetzt, z.B:
HgS + O2 ⟶ Hg + SO2 (beide als Dampf) .
- Die Reduktion der Halogenide mit unedlen Metallen (HA)
ist für die frühen Übergangsmetalle bis Nb/Ta erforderlich, die aus ihren ionischen Fluoriden
erhalten werden können (vgl. bei den Lanthanoiden):
- Reduktion der Fluoride mit Ca, Mg (z.B. Y, La), z.B.
2 LaF3 + 3 Ca ⟶ 2 La + 3 CaF2
- Reduktion der Chloride mit Na, K (z.B. für Ac).
Für Elemente, die schon gediegen, d.h. als (edle) Metalle vorkommen, wird
- die Cyanid-Laugerei (CL) als Reinigungsverfahren benötigt.
Für die Reinigung und Abtrennung wird die Komplexbildung genutzt, z.B. für die
Gewinnung von Gold:
- Auflösung (Oxidation) von Au mit KCN und Preßluft:
2 Au + H2O + O2 + 4 KCN ⟶ 2 K[Au(CN)2] + 2 KOH
- Das Ausfällen des edlen Elementes kann z.B. mit Zn-Staub erfolgen:
2 K[Au(CN)2] + Zn ⟶ K2[Zn(CN)4] + 2 Au
Neuere Verfahren arbeiten mit der Adsorption der Lösung an Graphit (sog. CIP-Verfahren: Carbon in Pulp).
Speziell bei Gold sind dieser Abtrennung meistens noch Schweretrennungen und
Amalgamierung vorgeschaltet. Zur Gewinnung von hochreinem Feingold werden dann
weiter Chlorierungen (Miller-Prozess) und abschliessende Elektrolysen (Wohlwill-Elektrolyse)
durchgeführt.
Ganz generell werden auch häufig nicht die reinen Metalle, sondern gleich die
verschiedensten Legierungen hergestellt (z.B. Ferrovanadium), wenn die Elemente in Erzen
gemeinsam miteinander vorkommen (z.B. 3d-Element-Oxide).
Bei vielen Prozessen ist mit der wichtigste Schritt die Abtrennung von silicatischen
Bestandteilen, die praktisch bei allen Rohstoffen erforderlich ist. Bei den pyrometallurgischen
Verfahren wird meist eine sog. 'Verschlackung' durchgeführt, bei der man ausnutzen
kann, dass Alkali- oder Erdalkalimetallsilicate vergleichweise niedrig schmelzen und
vor allem ihre Schmelze eine geringere Dichte hat als die Schmelze der Metalle oder Metallerze
(s. beim Hochofenprozess).
Auch eine der Reduktion vorangehenden Abtrennung der Erze vom Begleitgestein (Silicate)
mittels sog. Flotationen ist eine sehr elegante Vorabtrennung (s. z.B. bei der Kupfergewinnung).
Im folgenden sollen für zwei technisch wichtige, nach verschiedenen Verfahren
erhältliche Metalle, die Elemente Eisen (und Stahl) und Kupfer die Details der technischen Prozesse
beschrieben werden.
8.2.4. Herstellung von Eisen und Stahl
s. im speziellen Kapitel 9.8. Eisengruppe.
8.2.5. Cu-Gewinnung
s. im speziellen Kapitel 9.1. Kupfer (Silber, Gold)
und das PDF zur Cu-Gewinnung zur letzten Stunde SS 2021.
8.2.5. Au-Gewinnung und Raffination
s. PDF zum Oberseminar Lehramt von 2013.
8.2.X. Sonderstunde: Verbindungen zwischen Metallen: Legierungen und intermetallische Phasen
Fast noch wichtiger als die reinen Metalle sind ihre 'Verbindungen', die Legierungen
oder intermetallischen Phasen.
Hierzu gibt es eine eigene Vorlesung Intermetallische Phasen, von
der hier nur einige wenige Details erwähnt werden: