Vorlesung Chemie der Metalle
8. Übergangsmetalle
8.1. Übersicht
Übergangsmetalle im engeren Sinn (manchmal auch Äußere Übergangsmetalle genannt)
sind die je 10 Elemente, bei denen die d-Schale aufgefüllt wird
(da d der Nebenquantenzahl l=2 entspricht und es damit 2l+1=5 Orbitale gibt).
Vgl. die Auffüllung von f-Schalen bei den (manchmal auch Innere Übergangsmetalle genannten)
Lanthanoiden und Actinoiden (je 14 Elemente).
Hier noch ein paar Links zu bewegbaren Abbildungen der 'Orbitale':
Einordnung der Übergangsmetalle in das Periodensystem
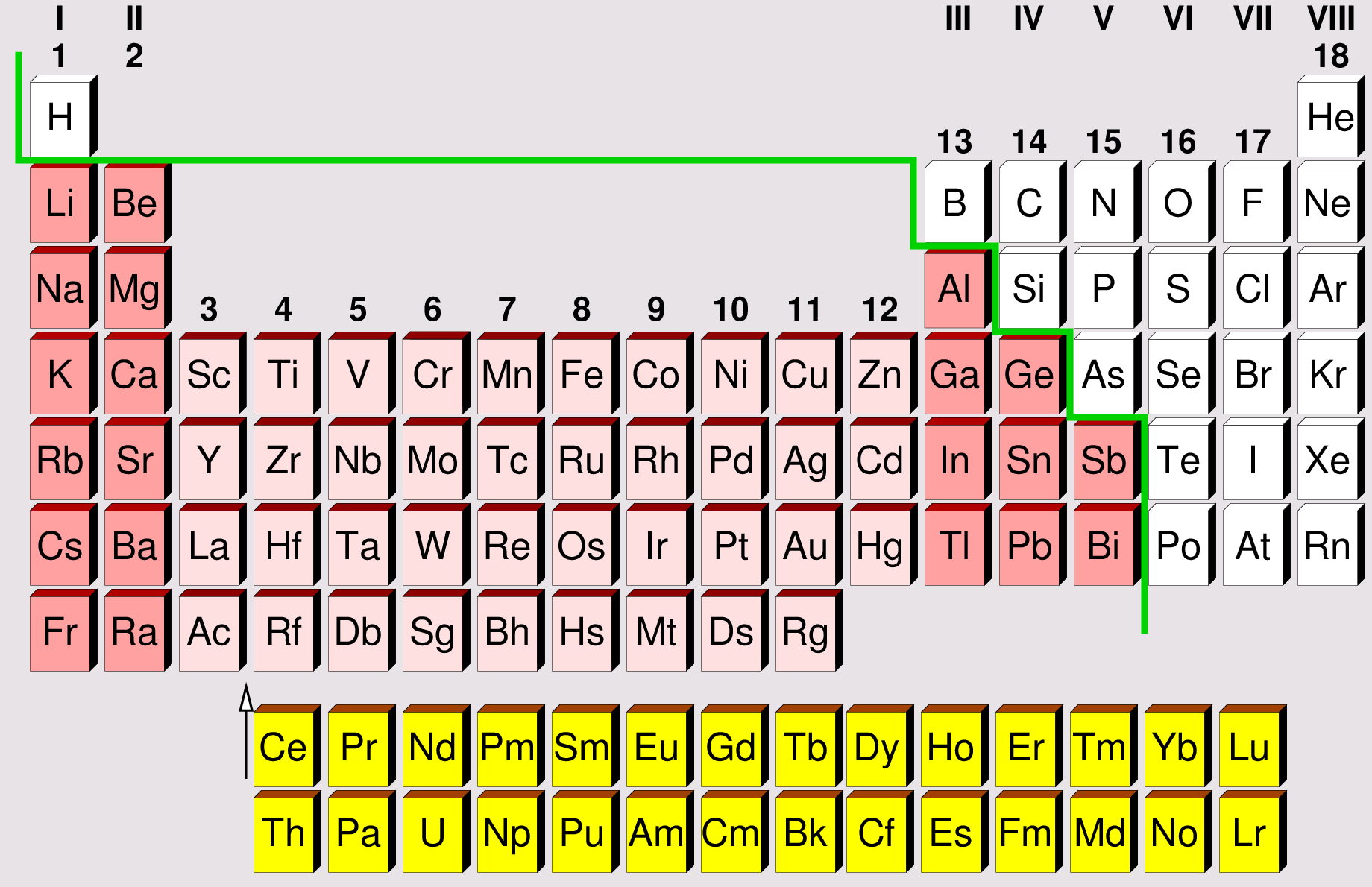 |
| Abb. 8.1.1. Periodensystem: Trennlinie Metalle - Nichtmetalle
‣SVG
|
Nach der Füllung der Ar-Schale (3p-Zustände)
erfolgt mit den Elementen K und Ca zunächst die Besetzung der 4s-Zustände,
erst danach werden die 3d-Niveaus gefüllt.
Die sogenannte erste oder 3d-Übergangsmetallreihe umfaßt die 10
Elemente
- Sc (Scandium),
- Ti (Titan),
- V (Vanadium),
- Cr (Chrom),
- Mn (Mangan),
- Fe (Eisen),
- Co (Cobalt),
- Ni (Nickel),
- Cu (Kupfer) und
- Zn (Zink).
Ganz analog werden in der nächsten Schale, nach Rb und Sr,
die 4d-Orbitale aufgefüllt.
Diese zweite Übergangsmetallreihe (auch 4d-Metallreihe) enthält die Elemente
- Y (Yttrium),
- Zr (Zirkon),
- Nb (Niob),
- Mo (Molybdän),
- Tc (Technetium),
- Ru (Ruthenium),
- Rh (Rhodium),
- Pd (Palladium),
- Ag (Silber) und
- Cd (Cadmium).
Nach Cs und Ba und der Besetzung der 4f-Schale bei den Lanthanoiden
werden dann die 5d-Niveaus mit Elektronen besetzt. Die Elemente dieser
dritten Übgangsmetallreihe (5d-Metalle) sind:
- Hf (Hafnium),
- Ta (Tantal),
- W (Wolfram),
- Re (Rhenium),
- Os (Osmium),
- Ir (Iridium),
- Pt (Platin),
- Au (Gold) und
- Hg (Quecksilber).
Bei der Benennung der Nebengruppen sind die Unterschiede in der 'alten' (meist
noch gebrauchten) und der 'neuen' (IUPAC, offiziell vorgeschriebenen) Nomenklatur
zu beachten:
- 3. Nebengruppe: Sc, Y, La, Ac (Gruppe IIIa, nach neuer Nomenklatur: 3. Gruppe)
- 4. Nebengruppe: Ti, Zr, Hf
- 5. Nebengruppe: V, Nb, Ta
- 6. Nebengruppe: Cr, Mo, W (6. Gr.)
- 7. Nebengruppe: Mn, Tc, Re (7. Gr.)
- 8. Nebengruppe (manchmal auch 0. Nebengruppe): Fe, Co Ni (auch Eisenmetalle) nach neuer Nomenklatur: 8., 9. und 10. Gruppe
- 1. Nebengruppe: Cu, Ag, Au (Ia, neue Nomenklatur: 11. Gruppe)
- 2. Nebengruppe: Zn, Cd, Hg (IIa, 12. Gruppe)
Als allgemeine Eigenschaften der Übergangsmetalle sind zu nennen:
- Alle Elemente sind Metalle, wobei Gänge von unedlen Metallen wie z.B. La
zu den sehr edlen Metallen Pt oder Au zu beachten sind.
- Elemente und besonders die Element-Ionen zeigen eine starke Tendenz zur Komplexbildung
also der Beteiligung von d-Zuständen an der chemischen Bindung
(vgl. Kapitel 8.3.)
- Die Chemie der Elemente ist durch die Stabilität vieler Oxidationsstufen
geprägt. Dies gilt inbesondere im Bereich d3 bis d6.
Da die Vielfalt der Chemie der Übergangsmetalle durch die große Zahl
möglicher Oxidationsstufen in Verbindungen geprägt ist,
gibt die folgende Tabelle zunächst
einen Überblick über die bei den einzelnen Elementen stabilen Wertigkeiten.
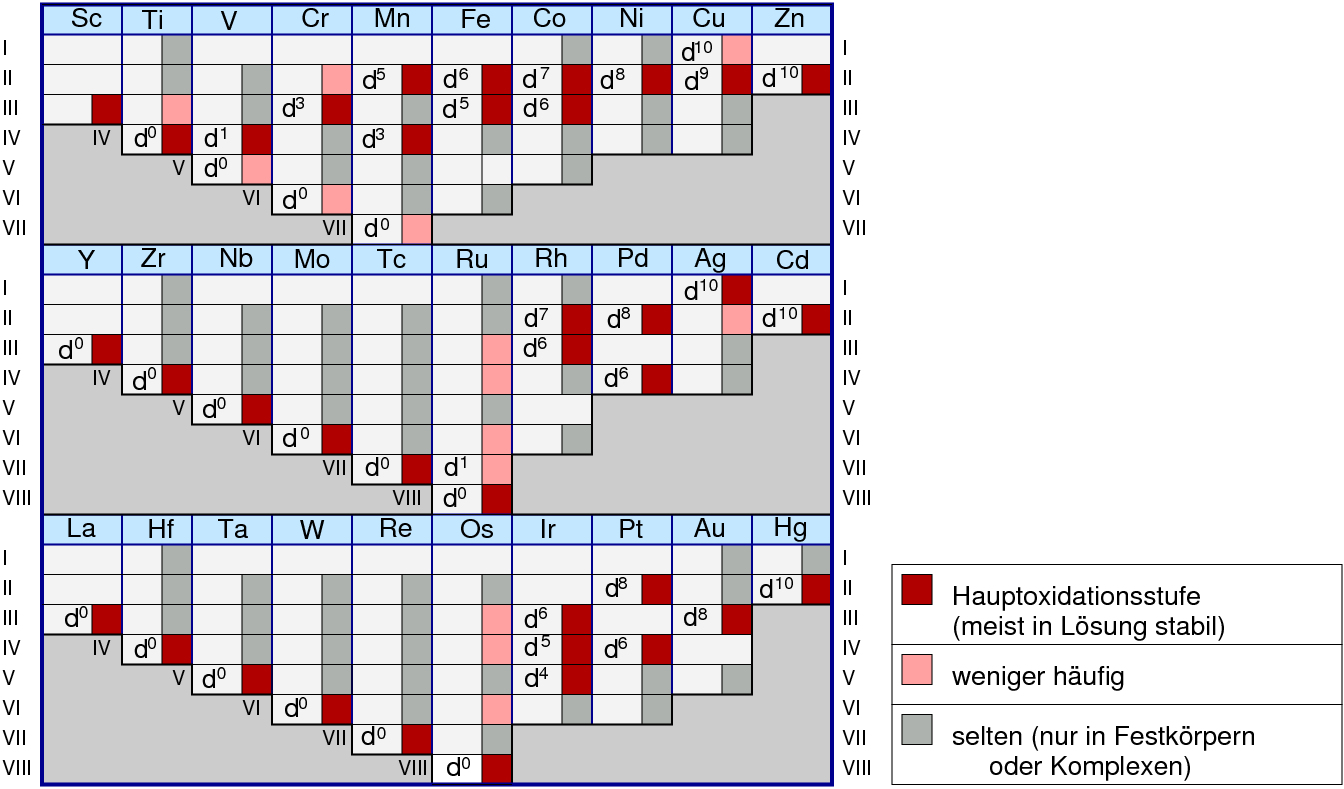 |
| Abb. 8.1.2. Übersicht der wichtigsten
Oxidationsstufen bei Übergangsmetallen
‣SVG
|
Rot gekennzeichnet sind die für das jeweilige Element wichtigsten Oxidationsstufen,
orange/rosa die weniger dominierenden, aber noch häufigen. Grau gekennzeichnete Elektronenkonfigurationen
werden nur in Festkörpern oder mit bestimmten Gegenionen/Liganden stabilisiert.
Hierbei ist nach dem HSAB-Konzept zu beachten, dass:
- besonders hohe Oxidationsstufen mit den 'harten' Gegenionen wie
F- oder O2- (d.h. in Fluoriden oder Oxiden bzw. Fluorido- oder Oxidometallaten)
stabilisiert werden,
- während 'weiche' und/oder π-Akzeptor-Liganden wie z.B. PR3 oder CO
das Auftreten der Metalle in
niedrigen Oxidationsstufen (z.B. 0 bei den Carbonyl-Komplexen) begünstigen.
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| +I |
|
d3 |
|
|
|
|
d8 |
d9 |
d10 |
|
| +II |
|
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
d9 |
d10 |
| +III |
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
|
| +IV |
|
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
|
| +V |
|
|
d0 |
d1 |
d2 |
d3 |
d4 |
|
|
|
| +VI |
|
|
|
d0 |
d1 |
d2 |
|
|
|
|
| +VII |
|
|
|
|
d0 |
|
|
|
|
|
| +VIII |
|
|
|
|
|
|
|
|
|
|
|
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| +I |
|
d3 |
|
|
|
d7 |
d8 |
|
d10 |
|
| +II |
|
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
d9 |
d10 |
| +III |
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
|
d8 |
|
| +IV |
|
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
|
| +V |
|
|
d0 |
d1 |
d2 |
d3 |
|
|
|
|
| +VI |
|
|
|
d0 |
d1 |
d2 |
d3 |
|
|
|
| +VII |
|
|
|
|
d0 |
d1 |
|
|
|
|
| +VIII |
|
|
|
|
|
d0 |
|
|
|
|
|
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
| +I |
|
d3 |
|
|
|
|
|
|
d10 |
|
| +II |
|
d2 |
d3 |
d4 |
d5 |
d6 |
|
d8 |
d9 |
d10 |
| +III |
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
|
d8 |
|
| +IV |
|
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
|
| +V |
|
|
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
|
| +VI |
|
|
|
d0 |
d1 |
d2 |
d3 |
d4 |
|
|
| +VII |
|
|
|
|
d0 |
d1 |
|
|
|
|
| +VIII |
|
|
|
|
|
d0 |
|
|
|
|
Tab. 8.1.1. Oxidationsstufen der Übergangsmetalle
Zu den Elektronenkonfigurationen bzw. Oxidationsstufen ist generell anzumerken,
dass sich in den Ionen alle Valenzelektronen in den d-Schalen aufhalten,
aber bei den neutralen Atomen der Elemente selber eine Umkehr bei halbbesetzter Schale
erfolgt, d.h. z.B. für elementares Chrom, dass nicht eine
d6 sondern vielmehr eine s1d5-Elektronenkonfiguration
vorliegt. Für die 'normale' Chemie der Übergangsmetall-Ionen sind diese
Details der freien Atome ohne jede Bedeutung, d.h. IMMER die beiden s-Elektronen in die d-Schale
einrechnen !!
Die Betrachtung der obigen Tabelle zeigt, dass die
Maximalwertigkeit für die frühen Übergangsmetalle der Gruppen-Nummer entspricht,
d.h. z.B. bei den ersten Elementen der 3d-Reihe von ScIII bis MnVII steigt.
Diese Ionen und ihre Chemie sind meist gut vergleichbar mit den jeweiligem Hauptgruppe-Elementionen
(z.B. Ti4+-Si4+, V5+-P5+, Cr6+-S6+, Mn7+-Cl7+).
Für die schwereren Elemente ist die höhere Oxidationsstufe stabiler als bei den leichten
(vgl. im Unterschied zu den Hauptgruppenelementen). Der Grund hierfür ist die Tatsache, dass die
Elektronendichte der 3d-Elektronen wegen der nicht vorhandener Knotenebene relativ kernnah ist und
diese Elektronen damit
nicht so leicht abgegeben werden wie die weiter ausgedehnten 4d- und 5d-Elektronen.
- Zur Ausdehnung/Grösse der Orbitale siehe dieses JAVA-Applet
- Zur energetischen Lage der einzelnen Zustände und zur Frage der Abschirmungen kann
man auf dieser Web-Seite selber
quantenchemische Rechnungen der freien Atome und auch der Ionen durchführen.
Der Verlauf der metallischen (rot) und der Radien der zweiwertigen Metallionen (für die Koordinationszahl 6, bei
kugelsymmetrischer Elektronendichteverteilung, grün) in Abbildung 8.1.3. gezeigt.
Dabei ist zu berücksichtigen, dass die 4s-Orbitale sehr viel weiter
ausgedehnt sind als die 3d-Orbitale. Z.B. liegen die radialen Dichtemaxima
im Fall von Cobalt bei 145 pm für das 4s- und 40 pm für die 3d-Orbitale.
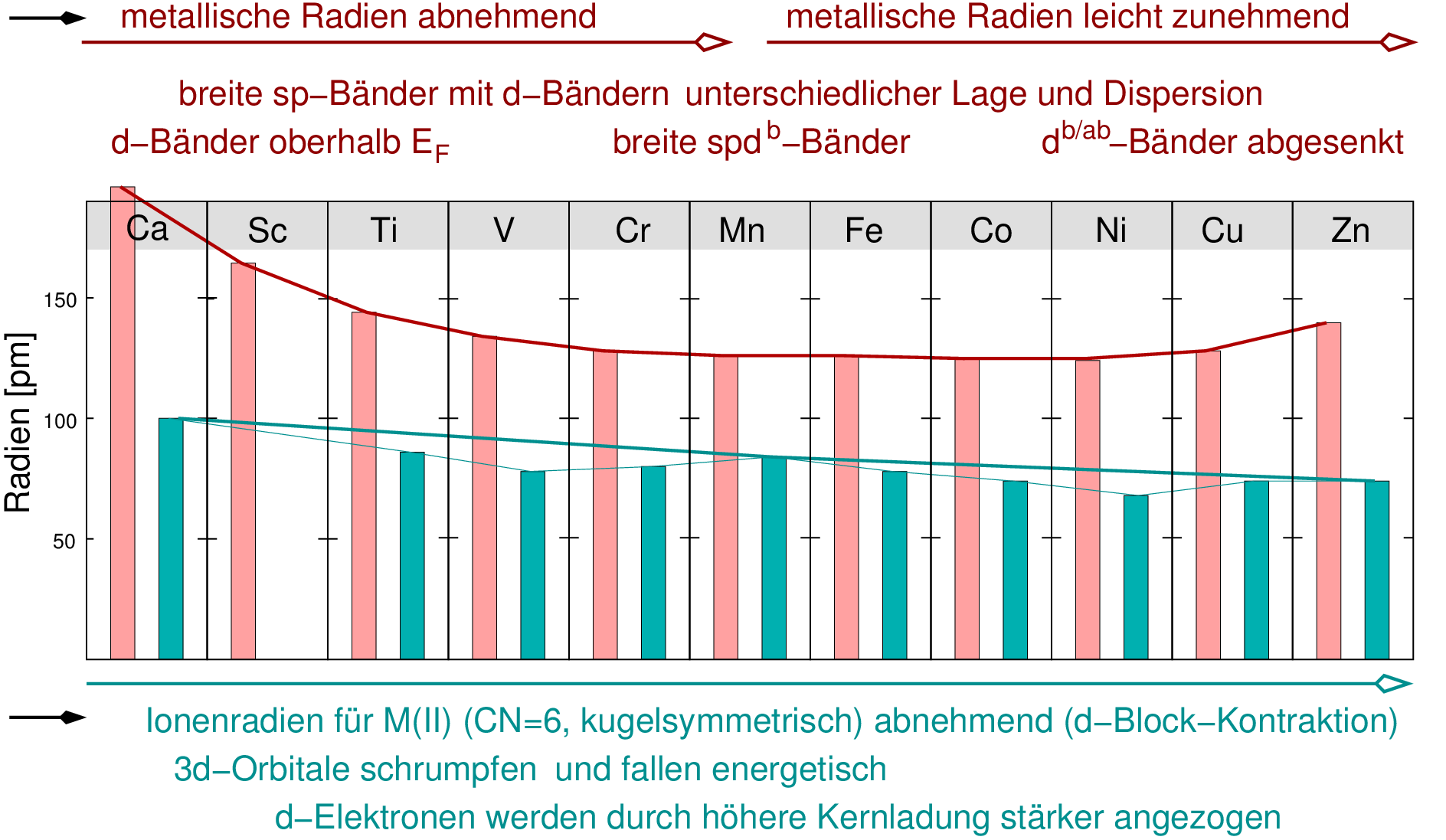 |
| Abb. 8.1.3. Verlauf
der metallischen und der Ionenradien für M(II) bei den Übergangsmetallen
der 3d-Reihe.
‣SVG
|
- Die sukzessive Füllung der 3d-Orbitale bewirkt eine immer bessere Abschirmung
der steigenden Kernladung und damit nach rechts fallende Ionenradien für die zweiwertigen Kationen,
bei denen die 4s-Niveaus ja nicht besetzt sind (grüne Balken in Abb. 8.1.3., d-Blockkontraktion).
Dies führt z.B. dazu, dass Zn2+-Salze oder Komplexe meist nur eine vierfache (tetraedrische)
Koordination aufweisen (z.B. auch in ZnO, Wurtzit-Typ), während für die übrigen 2-wertigen Ionen der 3d-Reihe
die oktaedrische Umgebung (CN=6, z.B. Hexaqua-Komplexe, NaCl-Struktur der Oxide etc.) dominiert.
- Bei den Metallradien (rote Balken) ist der Verlauf dagegen unterschiedlich: sie
fallen bis zur Mitte, dann steigen sie wieder. Zur Erklärung
dieses Verlaufs muss man sich die metallische Bindung und die Lage und Disperion der id-
Bänder genauer betrachten (s. dazu Kapitel 2.1.
der Vorlesung Intermetallische Phasen.
Wie die einzelnen Ionen in wässriger Lösung vorliegen, hängt
von der Koordinationszahl gegen O2-/OH-/H2O-Liganden ab, d.h.
von der Oxidationsstufe und von der Hauptquantenzahl.
Zusätzlich spielt der Protonierungsgrad der Wasser-Liganden eine Rolle,
der nicht nur vom pH-Wert, sondern ebenfalls von der Oxidationsstufe des
Metallions abhängig ist. Zusätzlich treten gerade bei den Oxidationsstufen
zwischen IV und VI pH-abhängig Kondensationsreaktionen
zu sog. Isopolyanionen (die protonierten Spezies nennt man Isopolysäuren) mit grossen Clustern auf.
Diese Anionen werden aktuell als sog. POMs = 'polyoxometallates' vor allem für
Anwendungen in der Katalyse wieder vermehrt untersucht.
Die folgende Tabelle gibt einen groben Überblick über die jeweils vorliegenden
Spezies am Beispiel der d0-Ionen. Zu bedenken ist außerdem, dass
der Kondensationsgrad immer auch von den Konzentrationen abhängt, die
Tabelle ist also bei weitem nicht vollständig!!
| M |
⟶ M-Radius und damit M-Koordinationszahl abnehmend ⟶ |
| 3d-M |
+II |
+III |
+IV |
+V |
+VI |
+VII |
| sauer |
[MII(H2O)6]2+ |
[MIII(H2O)6]3+ |
[MIV(OH)2(H2O)4]2+ |
[MV(O)2(H2O)4]+ |
[MVI2O7]2- |
[MVIIO4]- |
| neutral |
MIII(OH)3 ⇓ |
MIVO2 aq. ⇓ |
Isopoly-Anionen, z.B. [M10O28]6- |
⇵ |
| basisch |
MII(OH)2 ⇓ |
[MVO4]3- |
[MVIO4]2- |
| 4d/5d-M |
+II |
+III |
+IV |
+V |
+VI |
+VII |
| sauer |
[MII(H2O)6]2+ |
[MIII(H2O)6]3+ |
[MIV4(OH)8(H2O)16]8+ |
[MV(O)2(H2O)4]+ |
MVIO3 |
[MVIIO4(OH)2]3- |
| neutral |
MIVO2 aq. ⇓ |
Isopoly-Anionen, [M6O19]8- |
Isopoly-Anionen |
keine Isopoly-Anionen |
| basisch |
MV2O5 |
[MVIO4]2- |
Tab. 8.1.2. Übergangsmetall-Oxido-Spezies in wässrigen Lösungen
Man kann grob drei Bereiche unterscheiden:
- Bei den Metall-Kationen in niedrigen Oxidationsstufen von II oder III
liegen in wässriger Lösung einfache Hexaquakomplexe vor.
Aus dem bekannten Kationensäure-Charakter des Al3+-Komplexes
erkennt man jedoch bereits, dass die Wasserliganden im basischen auch hier schon
deprotoniert werden können und damit die Hydroxide ausfallen.
- Bei Metallionen in hohen Oxidationsstufen von VI oder VII
sind dagegen alle Wassermoleküle
komplett deprotoniert, da die p-Zustände von Sauerstoff an der Bindung zum
hochgeladenen Metall-Ion beteiligt sind. Abhängig vom Ionenradius
(klein = CN 4; gross = CN 6) treten Oxidometallat-Ionen mit Tetraedern oder
Oktaedern als Grundpolyedern auf. Diese können pH-abhängig
kondensiert werden (vgl. das Chromat/Dichromat-Gleichgewicht aus dem 1. Semester).
- Bei Metallen in der mittleren Oxidationsstufen IV und V liegen die Verhältnisse
zwischen diesen beiden Extremen und sind damit entsprechend vielfältig:
Bei 3d-Metallionen wie z.B. Ti(IV) sind im Sauren
meist zwei Wassermoleküle deprotoniert, es liegen also oktaedrische Komplexe
wie [Ti(OH)2(H2O)4]2+ vor.
Bei VV sind dann schon zwei Wasserliganden komplett deprotoniert.
Im basischen Milieu sind meist alle Liganden deprotoniert und es kommt wegen der
Oktaeder-Koordination direkt zur Kondensation und zur Bildung von Feststoffen
mit Rutil-Struktur (TiO2, MnO2, usw.).
Bei den 4d- und 5d-Metallionen der Oxidationsstufe +V
gilt Ähnliches, im Basischen fallen Feststoffe wie Nb2O5 o.ä. aus.
Am interessantesten ist V(V) ...
Am Beispiel von Vanadium(V) lassen sich die unterschiedlichen
Spezies auch im Experiment zeigen:
Während im Sauren oktaedrische Komplexe
[VV(O)2(H2O)4]+
vorliegen, erfolgt bei höheren pH-Werten,
ähnlich wie im Fall von Al-Sauerstoff-Ionen, zunächst Kondensation zu Isopolyanionen
wie [V10O28]6- (s. Abb. 8.1.4. links)
und erst in stark basischer Lösung liegt das isolierte Tetraeder-Anion
VO43- vor:
| ⚗ pH-Abhängigkeit der Oxido/Hydroxido-Metallat-Spezies am Beispiel von V(V)
(105MB|MP4|H264) |
|
|
Beim Auflösen von rotbraunem V2O5 in hochkonzentrierter
Natronlauge und anschliessendem Verdünnen liegen zunächst
farblose VO43--Ionen vor. Bei langsamer Zugabe
von halbkonzentrierter Schwefelsäure entsteht noch im basischen
das hellgelbe Divanadat-Ion V2O74- (vgl. Chromat/Dichromat-Gleichgewicht).
Im Bereich neutraler pH-Werte entstehen durch Kondensation die orangenen Isopolysäuren
wie z.B. das Decavanadat [V10O28]6-. Bei
sehr kleinen pH-Werten liegt schliesslich das gewinkelt gebaute Vanadyl-Kation als
Wasserkomplex [VV(O)2(H2O)4]+
vor, das wieder hellgelb ist.
|
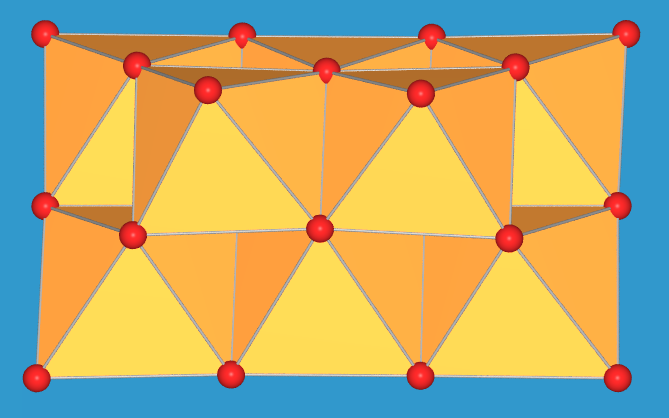 |
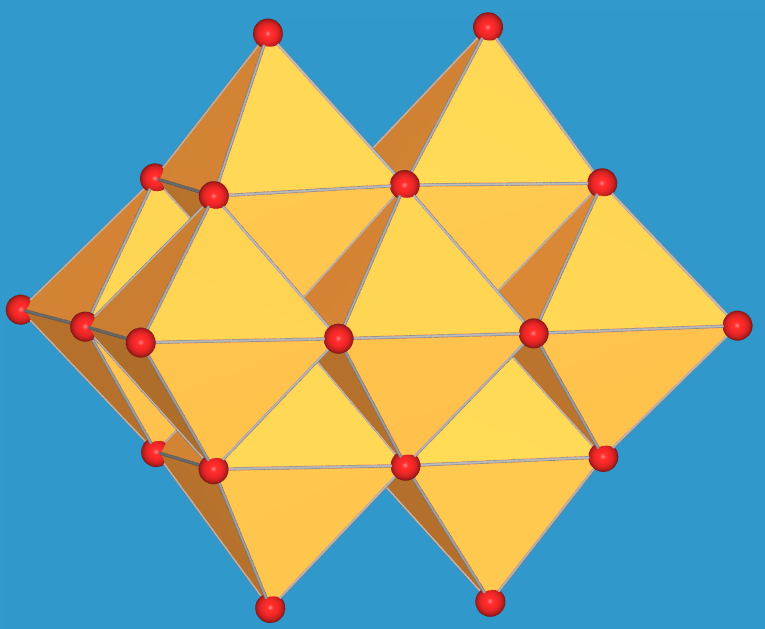 |
| 8.1.4. Isopolyvanadate(V): zwei
Ansichten des Polyanions [V10O28]6-
‣VRML
|
Im folgenden werden die wichtigsten Oxidationsstufen der Übergangsmetalle im Einzelnen (nach Gruppen)
kurz angesprochen und in Experimenten gezeigt, die fast immer darauf beruhen, dass die Spezies mit
der höchsten Oxidationsstufe (z.B. mit Zink/HCl) reduziert wird.
Von der III. bis zur VII. Nebengruppe ergibt sich ein einheitlicher Gang der maximalen
Oxidationsstufen, die immer der Gruppennummer entspricht:
- Die Elemente der III. Nebengruppe, Scandium (Sc), Yttrium (Y) und Lanthan (La) kommen
praktisch nur als dreiwertige Ionen mit einer d0-Elektronenkonfiguration vor.
Die folgenden Verbindungen sind jeweils typische Salze:
- Trihalogenide wie z.B. ScX3
- Oxide wie z.B. Sc2O3
- Oxidhalogenide wie z.B. LaOX
- Hydroxide wie z.B. Sc(OH)3
Damit ist die Chemie sehr vergleichbar mit der der in Kap. 7.1. besprochenen
Lanthanoide. Scandium ist z.T. auch dem Aluminium vergleichbar.
- Die Elemente Titan (Ti), Zirkonium (Zr) und Hafnium (Hf) der IV. Nebengruppe erreichen maximal
die Ladung 4+ (d0-Konfiguration), Ti kommt auch als
dreiwertiges (d1) und sogar auch als zweiwertiges Ion vor.
- Typische Verbindungen von Titan sind z.B.
- Bekannt sind Oxide wie TiO2 (in Rutil-, Anatas- oder Brookit-Modifikation), TiO
und diverse gemischtvalente tief-schwarzblaue Ti-Oxide.
- Die Halogenide TiX4 sind für alle Halogene X bekannt. Es handelt sich
um molekulare Flüssigkeiten mit zum SiCl4 ähnlichen Eigenschaften.
- Ti4+
(im Sauren als [TiIV(OH)2(H2O)4]2+, farblos)
kann in wässriger saurer Lösung mit Zink
zum blass-violetten Hexaquakomplex mit Ti3+ reduziert werden:
| ⚗ Reduktion von Ti(IV) mit Zn
(47MB|MP4|H264) |
|
Das UV/VIS-Spektrum mit dem Maximum bei 500 nm, der dem d-d-Übergang
zwischen den im oktaedrischen Feld
aufgespaltenen d-Zuständen entspricht,
gibt es aus dem
UV/VIS-Kapitel der
Methoden-Vorlesung oder direkt
HIER.
- Weitere typische niederwertige Ti-Verbindungen sind TiO oder Ti-Diorganyle TiR2.
- Es besteht eine gewisse Analogie zwischen Ti4+ und Si4+:
SiCl4 und TiCl4 sind stark hygroskopische molekulare
Flüssigkeiten. Die Hochdruckmodifikation
von SiO2, der sog. Stishovit, kristallisiert in der
Rutil-Struktur.
- Bei Zirkonium und Hafnium dominiert die Oxidationsstufe +IV deutlich. Bekannt sind
z.B. Zirkonia (ZrO2, als Diamant-Imitat) und Zirkon (ZrSiO4).
Zirkon liegt in wässriger saurer Lösung als kompliziert aufgebautes Ion
[Zr4(OH)8(H2O)16]8+
vor.
- ‣ Weitere Details
zu den Elementen der 4. Nebengruppe in
Kapitel 9: Titan-Gruppe.
- Vanadium (V), Niob (Nb) und Tantal (Ta), die Elemente der V. Nebengruppe, sind maximal
positiv 5-wertig (d0). Besonders das erste Element der Gruppe, Vanadium, ist aber auch 4- (d1), 3- oder 2-wertig.
- Typische Verbindungen von Vanadium sind
- Oxide und Halogenide wie
VVF5, VV2O5, VIVO2,
VIII2O3 oder auch VIIO.
- Vanadium(V) kann mit Zink im Sauren stufenweise reduziert werden, so dass
man fast alle Oxidationsstufen von Vanadium und die Farben ihrer in
saurer wässriger Lösung vorliegenden Ionen (s. unter und im Video)
betrachten kann:
| ⚗ Reduktion von V(V) mit Zn
(225MB|MP4|H264) |
|
|
Vanadium(V) kann mit Zink im Sauren stufenweise reduziert werden:
[VV(O)2(H2O)4]+ (gelb) ⟶
[VIV(O)(H2O)5]2+ (blau) ⟶
[VIII(H2O)6]3+ (grün) ⟶
[VII(H2O)6]2+ (violett)
Diese vierstufige Redoxreaktion ist auch Basis von sogenannten 'Redox-Flow'-Batterien,
die als stationäre Speicher elektrischer Energie diskutiert werden. In der Abbildung
sind die Entladevorgänge gezeigt.
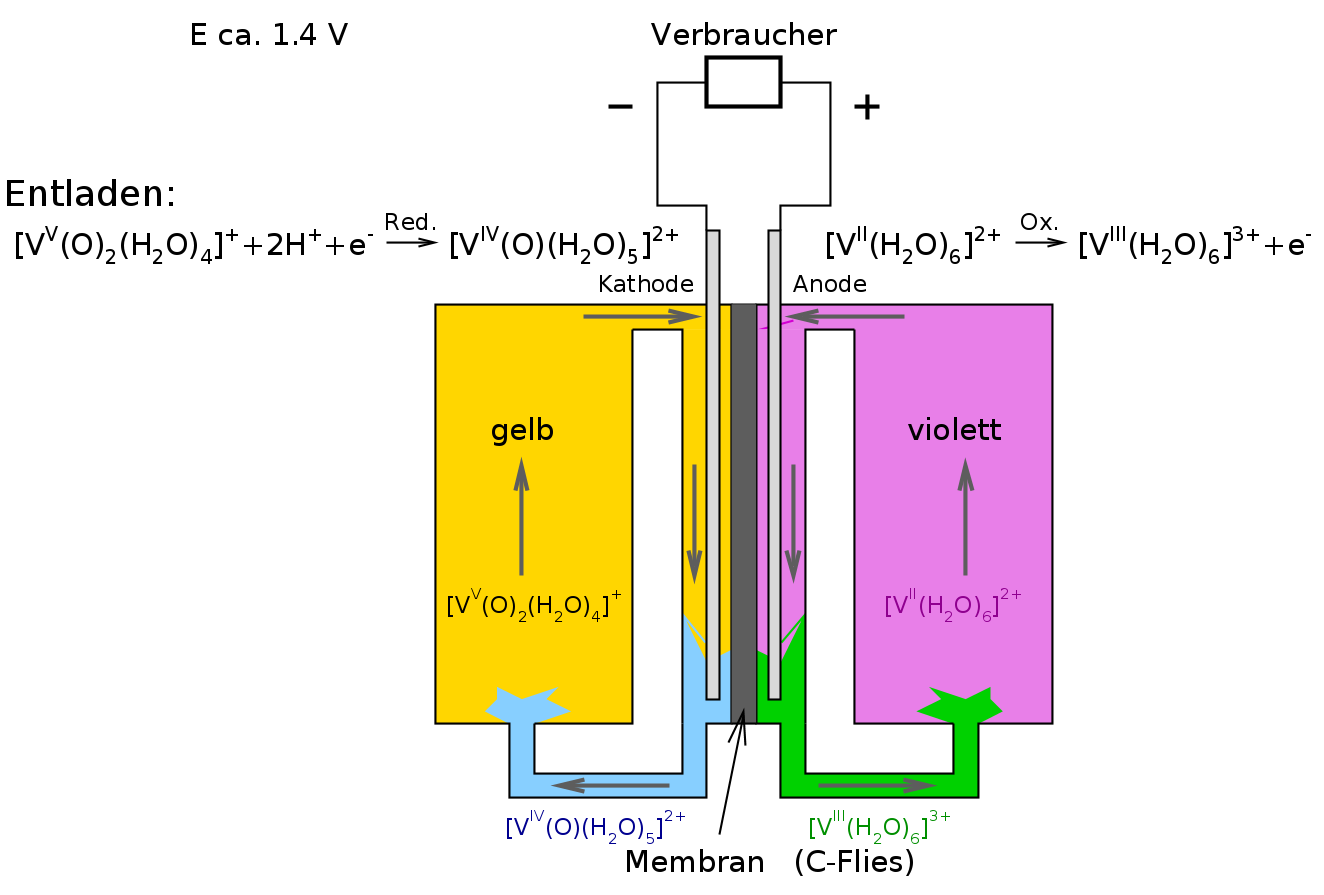
Prinzip der Vanadium 'Redox-Flow'-Batterie
‣SVG
|
Auch im Pourbaix-Diagramm (Abb. 8.1.5.) sind pH-abhängig die stabilen
Spezies für die verschiedenen Oxidationsstufen ablesbar:
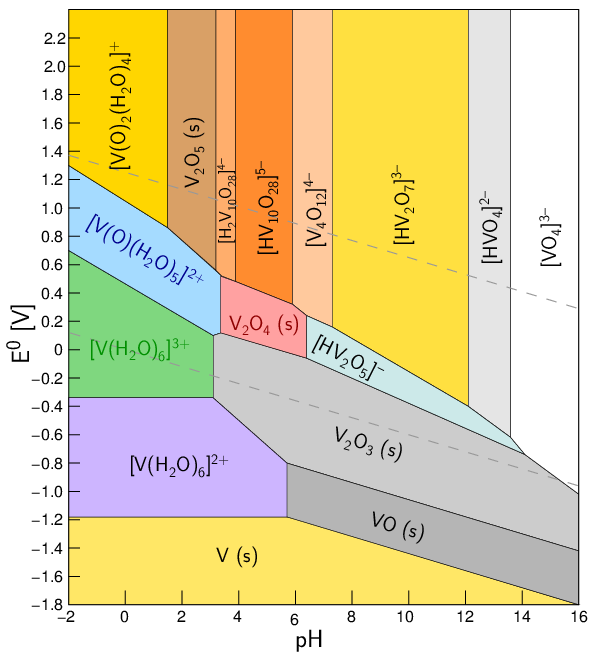 |
| 8.1.5. Pourbaix-Diagramm von
Vanadium.
|
- Zu den Oxido/Hydroxido-Spezies von Vanadium(V) in wässriger Lösung s. oben
sowie auch im Pourbaix-Diagramm in Abbildung 8.1.5.
- Für die ebenfalls sehr umfangreiche Oxochemie von V(IV) ist eine
quadratisch-pyramidale Koordination von Vanadium typisch, die z.B. im Cluster
[V18O42]12-, in Abb. 8.1.6. dargestellt, vorliegt.
Diese Cluster entstehen im Basischen bei der Kondensation der
Aquakomplexe wie [VIV(O)(H2O)5]2+
durch Deprotonierung und Kondensation. (Die im Pourbaix-Diagramm (Abb. 8.1.5.) eingezeichnete
Spezies [V2O4(OH)- enthält wohl
Dimere aus zwei kantenverknüpften quadratischen Pyramiden,
[(H2O)2VO(O)2VO(H2O)(OH)]-).
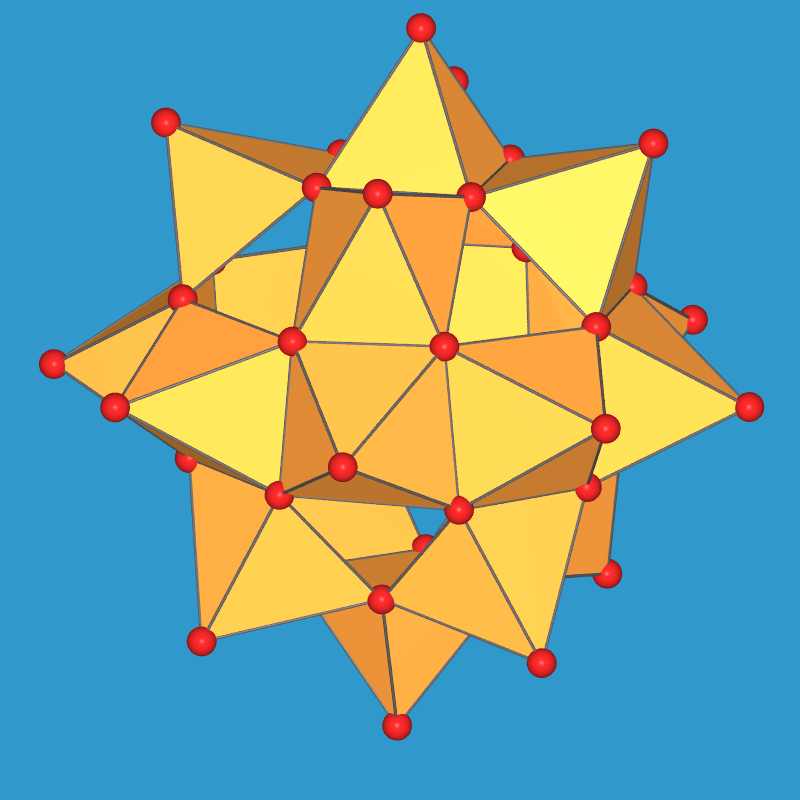 |
| 8.1.6. Das
Polyanion [V18O42]12-
‣VRML
|
- Einfach positiv geladen kommt Vanadium nur selten, z.B. in Komplexen wie
[V(bipy)3]+, vor.
- Es besteht eine gewisse Analogie zwischen der Chemie von V5+ und der von P5+.
- Bei Niob und Tantal dominiert die Oxidationsstufe 5+ sehr deutlich,
wie bei Vanadium sind aber auch alle anderen noch bekannt.
In neutralen und basischen wässrigen Lösungen tritt das aus sechs
Oktaedern oktaedrisch (Superoktaeder!) aufgebaute Isopolyanion [Ta6O19]8- auf
(Abb. 8.1.7.).
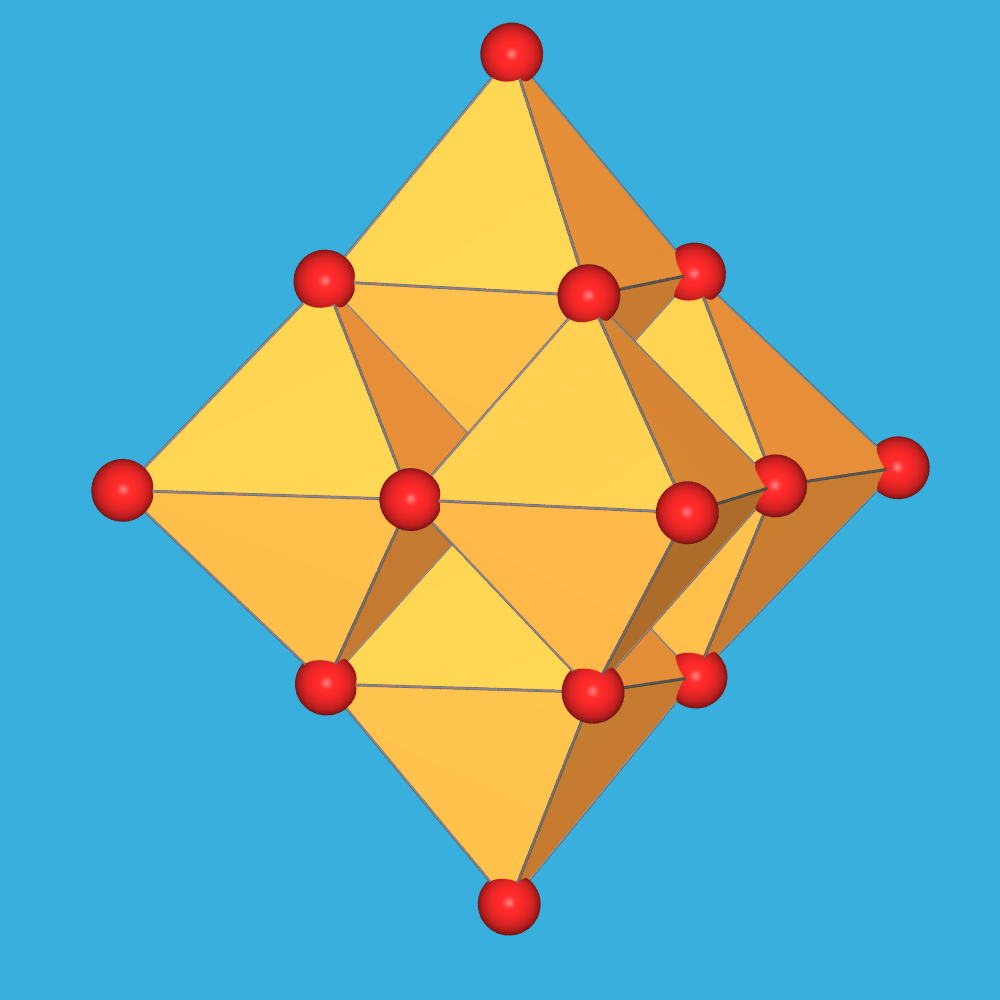 |
| 8.1.7. Das
Polyanion [Ta6O19]8-
‣VRML
|
- ‣ Weitere Details
zu den Elementen der 5. Nebengruppe in
Kapitel 9: Vandadium-Gruppe.
- Chrom (Cr), Molybdän (Mo) und Wolfram (W) (VI. Nebengruppe)
sind alle maximal sechswertig (d0-Konfiguration).
Auch +V (d1), +IV, +III (d3) und +II sind,
besonders bei Chrom, alle bekannt.
Es besteht wieder eine gewisse Analogie zwischen Cr+VI und S+VI
(Sulfat - Chromat; Disulfat - Dichromat; SO3 - CrO3).
Während jedoch CrVI ein starkes Oxidationsmittel ist, sind
MoVI und WVI recht stabil.
- Typische Verbindungen und Reaktionen von Chrom:
- Die Oxidationsstufen +VI finden sich in den
Chromaten wie CrVIO42-
und in CrO3. Chromate(VI) sind gelb bis rot, das Chromat-Gleichgewicht
ist dazu im Versuch gezeigt. Die Farbe resultiert aus L-M-Ladungsübertragung (LM-CT).
| ⚗ Chromat-Dichromat-Gleichgewicht
(17MB|MP4|H264) |
|
- Chrom(IV) (z.B. in CrO2) und Chrom(V) kommen nur sehr selten vor.
- +III (d.h. die d3-Elektronenkonfiguration)
ist die wichtigste Oxidationsstufe von Chrom. Wichtige Verbindungen sind hier
z.B. die Trihalogenide oder Cr2O3 sowie tausende
von Komplexen.
- Auch der 'Vulkan-Versuch' zeigt die beiden bei weitem wichtigsten Oxidationsstufen
von Chrom:
(N-IIIH4)2[CrVI2O7]
⟶ N02 + Cr+III2O3 + 4 H2O
| ⚗ Chromat-'Vulkan'
(22MB|MP4|H264) |
|
- Die Oxidationsstufe +II ist deutlich weniger stabil.
- und für Molybdän und Wolfram:
- Die Oxidationstufe +VI ist hier sehr stabil (WO3, Wolframate, Hexahalogenide)
- In Halogeniden und Oxiden sind alle anderen Oxidationsstufen
bis hinunter zu +II noch bekannt. Hier sind dann
Clusterverbindungen mit Mo-Mo bzw. W-W-Bindungen häufig.
- In saurer Lösung wird MoO42-, das bei
niedrigen pH-Werten zu verschiedenen Isopolymolybdaten reagiert,
mit Zink bis zu Mo(III) reduziert. In hochkonzentrierten Lösungen
liegt Mo(III) als grassgrünes diamagnetisches Oktaeder-Dimer
[Mo2(OH)2(H2O)8]4+ vor.
Beim Verdünnen entsteht der hellgelb-braune Aquakomplex
[Mo(H2O)6]3+.
Bei Zugabe von festem Natriummolybdat(VI) kommt es zur Synproportionierung
zwischen Mo(III) und Mo(VI) und es bildet sich das
grüne Ion [MoO(H2O)5]3+ (oder [MoOCl5]2-),
das mit weiterem Mo(VI) letztlich
gemischtvalentes blaues Mo(V/VI) (sog. Molybdän-Blau) ergibt:
| ⚗ Redoxreaktionen von Molybdän
(95MB|MP4|H264) |
|
- Die entsprechende Reduktion von Wolfram(VI) endet bei gleichen Bedingungen
bei gemischtvalenten
intensiv blauen W(V/VI)-Spezies (W-Blau), was wiederum den
Gang in der Stabilität der Oxidationsstufen in den Nebengruppen zeigt:
| ⚗ Reduktion von Wolframat(VI)
(38MB|MP4|H264) |
|
- Die sogenannte Wolframbronzen NaxWO3 mit
Perowskit-Struktur
bzw. vom Perowskit abgeleiteten Strukturen
sind ebenfalls gemischtvalente Verbindungen. Abhängig von x sind
sie farbig bis goldmetallisch glänzend.
- ‣Weitere Details
zu den Elementen der 6. Nebengruppe in
Kapitel 9: Chrom-Gruppe.
- Mangan (Mn), Technetium (Tc) und Rhenium (Re)
(VII. Nebengruppe) kommen maximal als 7-wertige Ionen (mit der d0-Elektronenkonfiguration)
vor, alle anderen Oxidationsstufen bis zu +II sind jedoch, besonders bei Mangan,
ebenfalls bekannt:
MnVII ist ein starkes Oxidationsmittel, stabiler sind
hier vor allem MnIV (d3) und MnII (d5).
- Sehr viele der bekannten Oxidationsstufen von Mangan
sieht man im folgenden Versuchsvideo:
| ⚗ Reduktion von Permanganat
(225MB|MP4|H264) |
|
|
Mit Perborat (NaBO2 . H2O2 . 3 H2O)
kann Permanganat stufenweise reduziert werden:
MnVIIO4- (violett) ⟶
MnVIO42- (grün) ⟶
MnVO43- (blau) ⟶
MnIVO2 (braun)
|
- Die Chemie von Technetium ist wegen der Radioaktivität des Elementes deutlich
weniger gut untersucht.
- Beim Rhenium dominiert die Oxidationsstufe +VII, aber auch alle anderen Oxidationsstufen sind bekannt.
Bekannt ist z.B. ReO3, eine Re(VI)-Verbindung. In wässrigen Lösungen
existieren z.B. Spezies wie [ReO4(OH)2]3- oder
im Festkörper auch reine Oxido-Rhenate [ReO6]5-.
- ‣Weitere Details
zu den Elementen der 7. Nebengruppen in
Kapitel 9: Mangan-Gruppe (im Aufbau).
Bei den folgenden Elementen der VIII., I. und II. Nebengruppe nimmt
die Fähigkeit zur Abgabe der Elektronen der d-Schale fortschreitend wieder ab, so dass
die letzten Elemente nur noch zweiwertig vorkommen. Es bietet sich daher eine
Besprechung 'rückwärts' an:
- Die Elemente der 12./II. Nebengruppe, Zink (Zn), Cadmium (Cd) und Quecksilber (Hg) treten fast ausschließlich als 2-wertige Ionen
auf.
D.h. dass in den Verbindungen von Zn, Cd und Hg die voll besetzte d10-Schale
keine Rolle mehr für die Chemie spielt.
Die Elemente und vor allem viele einfache Verbindungen zeigen daher
starke Analogien zu den Elementen der II. Hauptgruppe, z.B.
die Halogenide MX2 und
Oxide MO.
Eine Ausnahme von der reinen Zweiwertigkeit ist Quecksilber, das in einwertigen Verbindungen
Hg-Hg-Bindungen ausbildet. Das entsprechende Ion Hg22+
ist in Wasser stabil und bildet ein schwerlösliches weißes Chlorid
Hg2Cl2 (Kalomel) (vgl. HCl-Gruppe des Kationentrennungsgangs).
| ⚗ Hg-Nachweis mit Ammoniak
(19MB|MP4|H264) |
|
|
Bei Zugabe von Ammoniak zu Kalomel erfolgt Disproportionierung gemäß:
Hg+I2Cl2 + NH3 ⟶
Hg+IINH2Cl + Hg0 (schwarz) + HCl
|
- Bei den davor stehenden Elementen Kupfer (Cu), Silber (Ag) und Gold (Au), der
11./I. Nebengruppe,
ist entsprechend die Einwertigkeit (ebenfalls volle d10-Schale)
dominierend, es gibt jedoch auch Verbindungen bis zur Oxidationsstufe +V:
- Für Kupfer sind zwei- und auch ein-wertige Ionen sehr häufig.
Typische Verbindungen sind CuO und Cu2O (Cuprit), auch alle Halogenide
dieser Oxidationsstufen sind bekannt.
Wegen der hoher Hydratationsenthalpie (Coulomb-Wechselwirkung) sind Cu2+-Ionen
in wässriger Lösung als verzerrt oktaedrische (Jahn-Teller-Verzerrung!)
Ionen [Cu(H2O)6]2+ stabil.
Entsprechend gibt es viele CuII-Salze von Oxosäuren (z.B. Sulfate).
Die Oxidationsstufe +III kommt in den Oxidocupraten (Hochtemperatursupraleiter) vor, auch Cu(IV) ist
noch bekannt.
| ⚗ Fehling-Probe
(26MB|MP4|H264) |
|
|
In der Fehling-Probe wird die Redoxchemie von Kupfer zum Nachweis
reduzierender Substanzen (z.B. von Zuckern) ausgenutzt.
Dabei wird im stark Alkalischen der quadratisch planare blaue Di-Tartrato-Komplex von Cu(II)
(Struktur) zu
rotbraunem Cuprit CuI2O (Struktur) reduziert.
|
- Silber kommt vor allem einwertig vor und ist - im Unterschied zu Cu+ -
auch in wässriger Lösung beständig. AgI-Oxid und alle schwerlöslichen
Halogenide AgIX sind bekannt.
Die Oxidationsstufe +II ist in wässriger Lösung instabil, H2O wird zu O2 oxidiert,
ist aber als Fluorid AgF2 im Festkörper bekannt. Auch einige wenige Verbindungen mit Silber
in den Oxidationsstufen +III und +IV konnten hergestellt werden.
- Bei Gold ist dagegen die Oxidationsstufe +III (d8) in Lösungen am stabilsten.
Dabei wir meist die quadratisch planare Umgebung bevorzugt, s. z.B.
die Struktur von AuF3.
Aber auch +I und seltener +II sind bekannt. Die höchste Oxidationsstufe ist
+V in AuF5. Die oktaedrische Koordination
wird hierin durch die optimale LS-d6-Elektronenkonfiguration stabilisiert.
- ‣ Weitere Details
zu den Elementen der I. Nebengruppe/11. Gruppe in
Kapitel 9: Cu, Ag, Au (im Aufbau).
- Die neun Elemente der VIII./0. Nebengruppe/10. Gruppe bilden den
Übergang zwischen der VII. Nebengruppe (Mn, Tc, Re) links
(bis zur maximalen Oxidationsstufe) und der
I. Nebengruppe rechts, mit den nur deutlich geringeren Oxidationsstufen
bei Cu, Ag und Au. Entsprechend ergeben sich in der Gruppe
die folgenden Tendenzen:
| . |
⟶ maximale OS abnehmend ⟶ |
|
maximale OS zu- nehmend |
Fe |
Co |
Ni |
| Ru |
Rh |
Pd |
| Os |
Ir |
Pt |
- Von links nach rechts nimmt die Stabilität der höhere Oxidationsstufen ab,
in der 5d-Reihe werden dabei die maximalen Werte erreicht:
- Die maximale Oxidationsstufe von Os ist +VIII (z.B. in OsO4).
- Das Nachbarelement Iridium erreicht nur noch die Oxidationsstufe +VI.
- Platin liegt bevorzugt als Pt(II) (d8) und Pt(IV) (d6) vor.
- In der 3d-Reihe ist diese Tendenz weniger ausgeprägt:
- Eisen liegt bevorzugt als Fe(III) (d5) oder seltener als
Fe(II) (d6) vor.
| ⚗ Oxidation von Eisen
(39MB|MP4|H264) |
|
|
Unter stark oxidierenden Bedingungen (z.B. bei
der Umsetzung einer basischen Lösung von FeCl3 mit elementarem Chlor)
kann Fe(VI) in Form des tiefrot-violetten Tetraoxido-Ferrat-Ions [FeO4]2-
erhalten werden. Dieses Ion ist nur unter basischen Bedingungen stabil,
im Neutralen oxidiert es Wasser zu Sauerstoff und wird dabei wieder zu Fe(III) reduziert.
|
- Cobalt kommt sowohl zwei- als auch besonders häufig drei-wertig vor.
Co(+III) hat eine d6-Elektronenkonfiguration, die meisten Komplexe
diese Ions sind oktaedrisch gebaute diamagnetische 'Low-Spin'-Komplexe.
- Für Nickel dominiert die Oxidationsstufe +II (d8, quadratisch planares
Ligandenfeld).
- Nach unten steigt die Stabilität der maximalen Oxidationsstufe, wie in allen
Nebengruppen:
- Fe: vor allem +II und +III
- Ru: +III und +IV wichtig, aber fast alle anderen auch bekannt
- Os: bis +VIII
- ‣ Weitere Details
zu den Elementen der 0. Nebengruppe/10. Gruppe in
Kapitel 9: Fe, Co, Ni, Pt-Metalle (im Aufbau).
Übersicht Oxidationsstufen
- Bei den frühen Übergangsmetallen der Sc- bis Mn-Gruppe
ergibt sich ein recht einheitliches Bild: Die maximale
Oxidationsstufe entspricht der Gruppen-Nummer
(z.B. Sc: +III bis Mn: +VII für die 3d-Reihe).
Tendenziell bevorzugen bekanntermaßen die schwereren Homologe
die höheren Oxidationsstufen. Dies ist vor allem darauf zurückzuführen,
dass die 3d-Orbitale deutlich weniger ausgedehnt sind als die 4d- und 5d-Zustände
(3d ohne Knotenebene, d.h. vergleichsweise Kern-nah). Aus der Beobachtung,
dass von Sc bis Mn die Ionenradien der zweiwertigen Kationen abnehmen (s. Abb. 8.1.3.) wird deutlich,
dass die d-Orbitale schrumpfen.
- Bei den Eisen- (Fe, Co, Ni)- und Platin- (Rh, Ru, Pd; Os, Ir, Pt)-Metallen
(d.h. in der VIII. Nebengruppe bzw. der 8,. 9. und 10. Gruppe)
kehrt sich die Stabilität wieder um, die maximale
Oxidationsstufe fällt, die Tendenz zur Abgabe der d-Elektronen
fällt von links nach rechts (z.B. Os: +VIII, aber Ni nur noch bis +II).
Hier beobachtet man, dass die Kationenradien weiter fallen, die d-Elektronen
also durch die höhere Kernladung zunehmend stärker angezogen werden.
- In der I. Nebengruppe = 11. Gruppe (Elemente Cu, Ag und Au)
ist die Tendenz zur Ausbildung höherer Oxidationsstufen
noch geringer, Kupfer und Silber kommen nur ein- und zweiwertig vor,
bei Gold erreicht man AuV mit harten Gegenionen/Liganden.
- In der 12. Gruppe (II. Nebengruppe; Elemente Zn, Cd, Hg)
ist keine Tendenz mehr zur Abgabe von d-Elektronen
feststellbar. Alle Elemente bilden maximal zweiwertige Ionen
mit d10-Elektronenkonfiguration.
Zum Abschluß der Übersicht der sehr allgemeine Vergleich
zwischen Hauptgruppen und Nebengruppen:
- Die Analogien zwischen Haupt- und der entsprechenden Nebengruppen sind
ziemlich gering und die Chemie der entsprechenden Elemente derselben Neben/Haupt-Gruppe
ist nur sehr bedingt vergleichbar.
Für die Ionen in der maximalen Oxidationsstufe gibt es aber einige Analogien,
besonders, wenn die Ionenradien vergleichbar sind:
- Ag+ - Rb+
- Cd2+ - Sr2+
- Sc3+ - Al3+
- Ti4+ - Si4+
- V5+ - P5+
- Cr6+ - S6+
- Mn7+ - Cl7+
- Die Unterschiede zwischen Haupt- und Nebengruppen sind dagegen sehr ausgeprägt:
- Metalle - Nichtmetalle:
- Bei den Hauptgruppen stehen oben rechts die Nichtmetalle.
- Bei den Nebengruppen sind alle Elemente Metalle.
- Oxidationsstufen
- In den Hauptgruppen ändern sich die Oxidationsstufen immer um zwei Stufen,
bei den Nebengruppe sind dagegen Änderung in beliebig kleinen Schritten normal.
- In den Hauptgruppen sinkt die Stabilität der maximalen Oxidationsstufe mit steigender
Ordnungszahl (TlIII ist weniger stabil als AlIII), in den
Nebengruppen sind die Tendenzen genau umgekehrt (OsVIII ist bekannt, aber
FeVIII ist unbekannt).
Die Aufteilung der weiteren Unterkapitel vom Abschnitt 8 ist:
In jedem Unterkapitel gibt es zu den einzelnen Verbindungsklassen
tabellarische Übersichten und es können aus Zeitgründen immer
nur einige Beispiele im Detail behandelt werden, wie z.B. bei den Elementen (Kap. 8.2.)
die Herstellung der technisch wichtigen Metalle Eisen und Kupfer.
Bei Halogeniden (Kap. 8.4.) Mo-Cluster (Chevrell-Phasen).
Bei Oxiden (Kap. 8.5.) einige technisch wichtige Verbindungen wie z.B. TiO2.









