 |
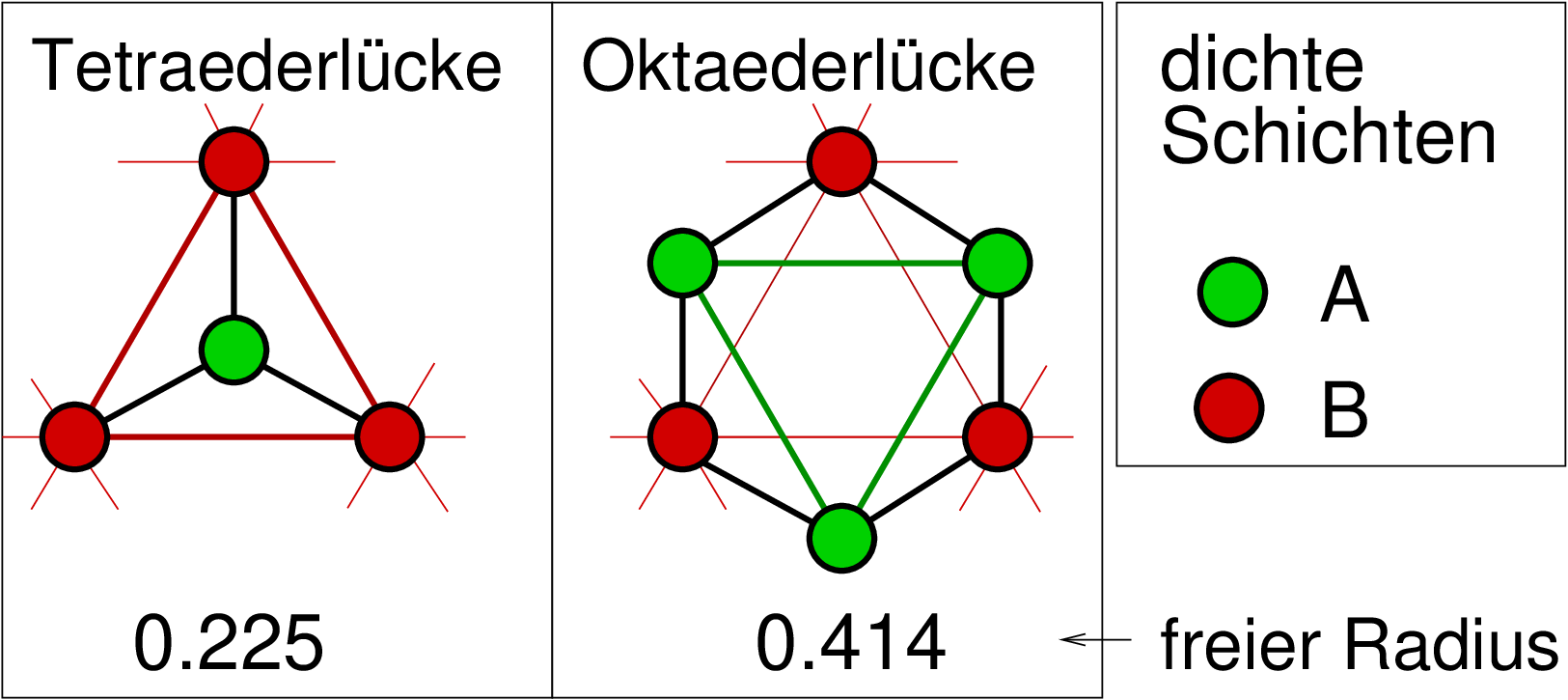
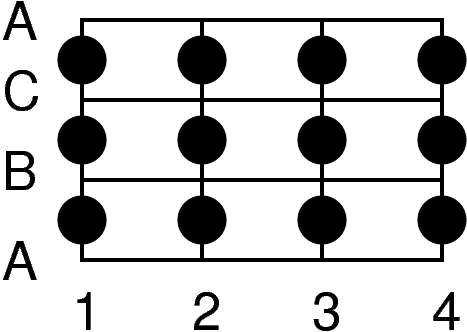
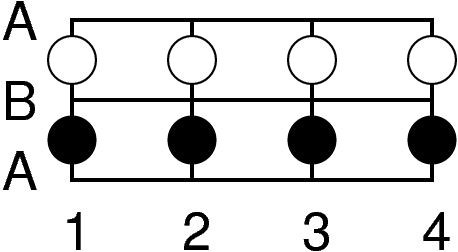
| Abb. 4.3.1. Tetraeder- (links) und Oktaederlücke (rechts) zwischen dichtgepackten Schichten A und B ‣ SVG |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
Ein zweiter Ansatz zum Verständnis und zur Darstellung von Strukturen ionischer Verbindungen basiert auf der Besetzung von Lücken (durch Kationen) in dichtesten Packungen der Anionen, so dass an dieser Stelle zunächst die Zahl, Größe und Verknüpfung dieser Lücken betrachtet werden sollen. Die beiden wichtigsten Arten dichtester Kugelpackungen, die beide auf Basis dicht gepackter hexagonaler Kugelpackungen in der Ebene, mit der Stapelfolge |:AB:| (h.c.p.) bzw. |:ABC:| (f.c.c.) beschrieben werden können (s. Kap. 3.2.), enthalten beide für N Atome insgesamt N Oktaederlücken und 2*N Tetraederlücken:
Die Art der Lücken und ihre Position zwischen zwei dicht gepackten Schichten A und B ist der Abbildung 4.3.1. zu entnehmen:
 |
| Abb. 4.3.1. Tetraeder- (links) und Oktaederlücke (rechts) zwischen dichtgepackten Schichten A und B ‣ SVG |
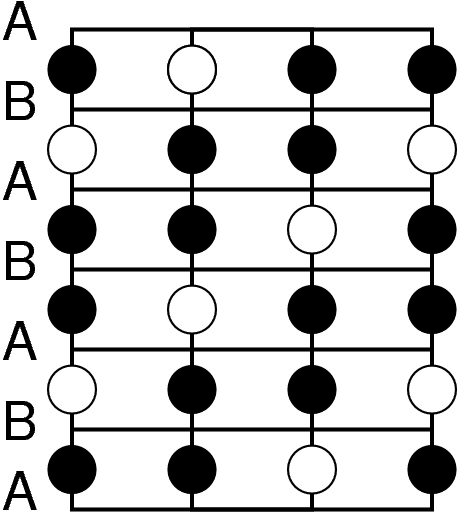
Die Positionen der Lücken sind in der Abbildung 4.3.2. eingezeichnet:
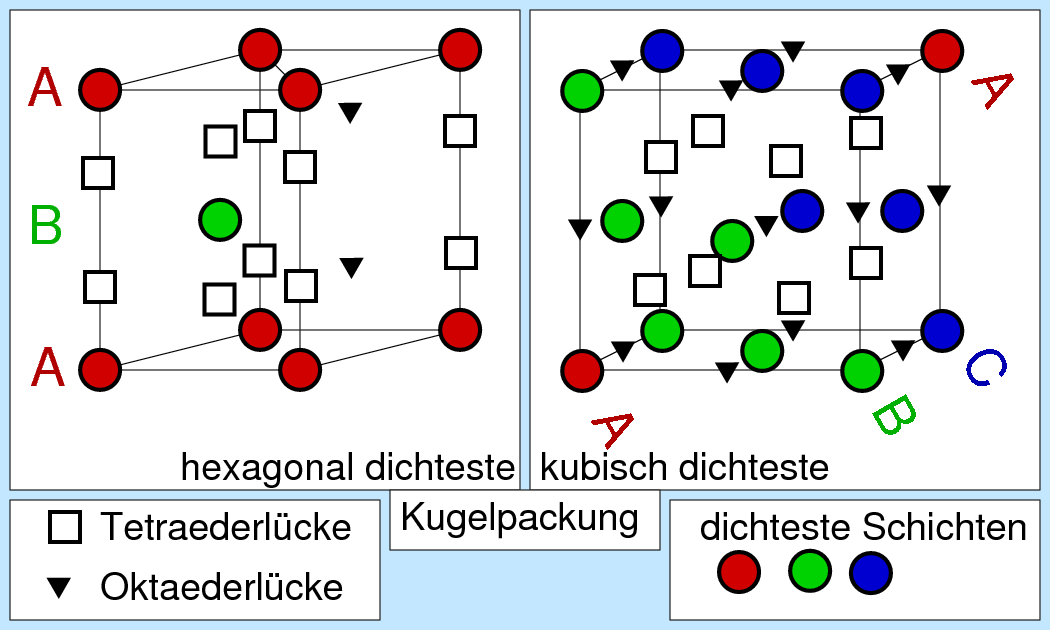 |
| Abb. 4.3.2. Positionen der Lücken in der hexagonalen (links) bzw. kubisch (rechts) dichtesten Kugelpackung ‣ SVG |
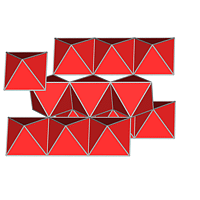
Jede der Kugelpackungen besitzt N Oktaeder- und 2N-Tetraederlücken auf N Kugeln, wie man leicht aus der Abbildung 4.3.2. ausrechnen kann). Da keine weiteren Lücken vorhanden sind, parkettieren 2N Tetraeder und N Oktaeder den Raum (z.B. zwischen zwei Schichten AB), wie die Bilderserie zu Lücken in dichten Packungen (zwischen 2 dichtesten Schichten A und B) zeigt:
Für die Verknüpfung der Polyeder in Ionenkristallen ist die 3. Paulingsche-Regel wichtig, die eine Aussage über die günstige Anordnung der Oktaeder- und Tetraederlücken zueinander macht:
Gemeinsame Kanten und besonders Flächen destabilisieren eine Struktur. Dies gilt speziell für hochgeladene Kationen mit kleinen Koordinationszahlen.
Es ist daher zunächst festzustellen, wie die Verknüpfung der Lücken konkret in den beiden dichtesten Kugelpackungen aussieht.
| Verknüpfung der Oktaederlücken untereinander | ||||||
| h.c.p. | Jede Oktaederlücke ist | flächen- | verknüpft mit | 2 | Oktaederlücken | (zwischen den Schichten) |
| kanten- | 6 | (in der Schicht) | ||||
| f.c.c. | flächen- | 0 | - | |||
| kanten- | 12 | (6 in der Schicht+3o+3u) | ||||
| Verknüpfung der Tetraederlücken untereinander | ||||||
| h.c.p. | Jede Tetraederlücke ist | flächen- | verknüpft mit | 1 | Tetraederlücken | (zwischen den Schichten) |
| kanten- | 3 | (in der Schicht) | ||||
| f.c.c. | flächen- | 0 | - | |||
| kanten- | 6 | (3 in der Schicht+3o+3u) | ||||
Hiermit und mit 3. Pauling-Regel werden die folgende Beobachtungen zur Strukturchemie ionischer Verbindungen (speziell der Oxide) verständlich:
Viele Kristallstrukturen von salzartigen Verbindungen lassen
sich nun als dichte Packungen der Anionen beschreiben, in denen
die Lücken (Tetraeder- und/oder Oktaederlücken)
mit Kationen besetzt sind.
Die Übersicht beginnt jeweils mit der
Polyederdarstellung, in der alle Lücken besetzt sind.
Nach unten zu sind dann immer weniger Lücken besetzt.
Auf der Vorlage 4.3. sind noch weitere Abbildungen zur Schichtbesetzung enthalten.
| X hexagonal dicht | für beide Basispackungen | X kubisch dicht | ||||
| Anteil besetzter Lücken | Formel | CN(X) | ||||
|

|
1  |
MX | 6 |

|
|
| NiAs-Typ | NaCl-Typ | |||||
|
|
2/3 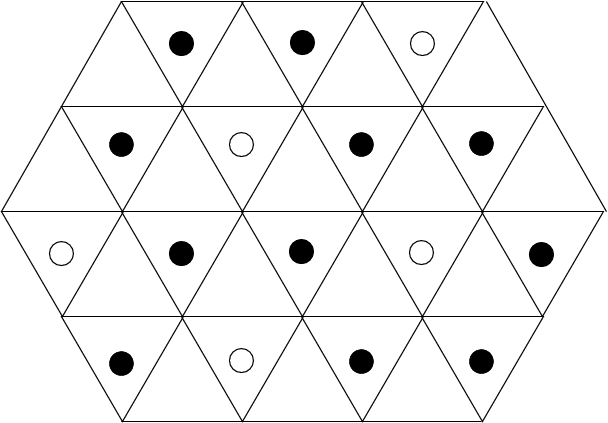 |
M2X3 | 4 | - | |
| Korund-Typ (Al2O3) | - | |||||
|

|
1/2: 1 und 0 | MX2 | 3 |

|

|
| CdI2-Typ | CdCl2-Typ | |||||
| . |
|
1/2 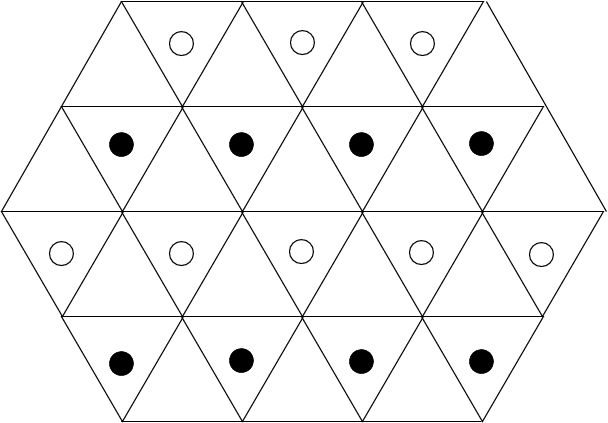 |
- | |||
| CaCl2-Typ (sehr ähnlich dem Rutil-Typ) | - | |||||
| . | 
|
1/2 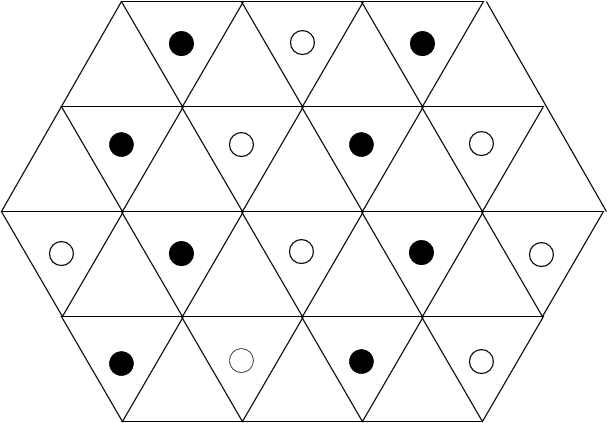 |

|
. | ||
| PbO2 | TiO2 (Anatas) | |||||
| . | 
|
1/2 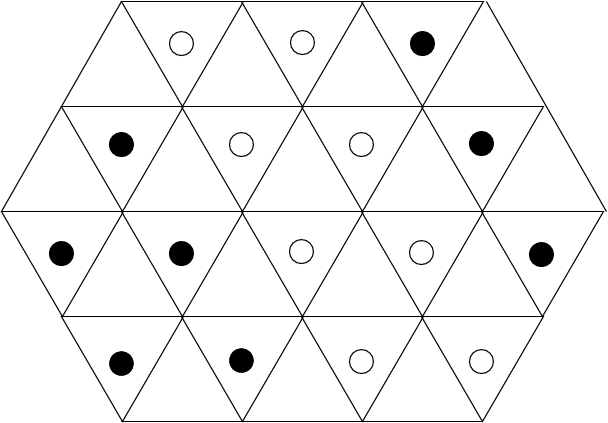 |
- | |||
| α-AlOOH (Diaspor) | γ-AlOOH (Böhmit, nicht ideal) | |||||
| NFe2 | 1/2: 1/3 und 2/3 | - | ||||
| . | 
|
1/3  |
MX3 | 2 | . | |
| ZrI3-Typ (Ketten) | . | |||||
| RhF3-Typ (Raumnetz) | - | |||||
| BiI3-Typ (Schichten) | 1/3: 2/3 und 0 | YCl3 | ||||
| α-NbI4 | 1/4 | MX4 | 2 u. 1 | NbF4 | ||
| α-Nb2I10 (molekular) | 1/5 | MX5 | 2 u. 1 | U2Cl10 (molekular) | ||
| - | UF5 (Kette) | |||||
| α-WCl6 | 1/6 | MX6 | 1 | - | ||
| X hexagonal dicht | für beide Basispackungen | X kubisch dicht | |||
| Anteil besetzter Lücken | Formel | CN(X) | |||

|
1 | M2X | 4:8 |

|

|
| ! unbekannt bei Salzen ! | Li2O (anti-CaF2-Typ) | ||||

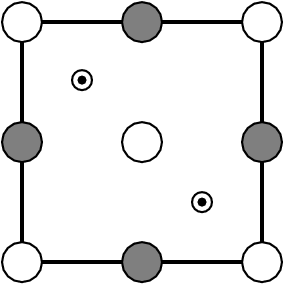
|
1/2 | MX | 4:4 |
|

|
| Wurtzit-Typ (ZnS) | Zinkblende-Typ (ZnS) | ||||

|

|
|
|||
| ß-BeO | PtS-Typ (!Achtung: Antityp!) | ||||
| . |
|

|
|||
| . | PbO-Typ (!Achtung: Antityp!) | ||||
| . | 1/4 | MX2 | 4:2 |

|
|
| ß-ZnCl2 | HgI2 | ||||
| . |

|
|
|||
| SiS2 | |||||
| . |

|
|
|||
| Cuprit-Typ (Antityp: OCu2) | |||||
| SnBr4 | 1/8 | MX4 | 4/1 | OsO4 | |
Die wichtigsten Strukturtypen von Ionenkristallen sind im folgenden Kapitel als Links auf die Strukturtypendatenbank zusammengestellt...
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |