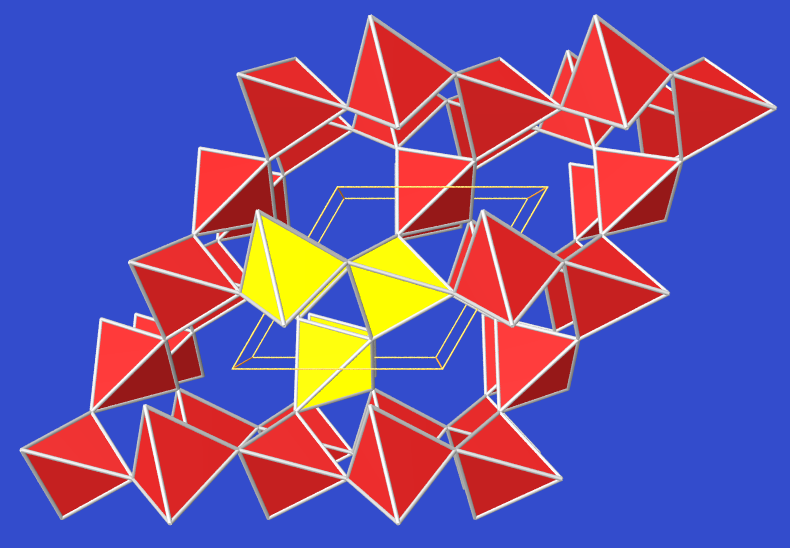
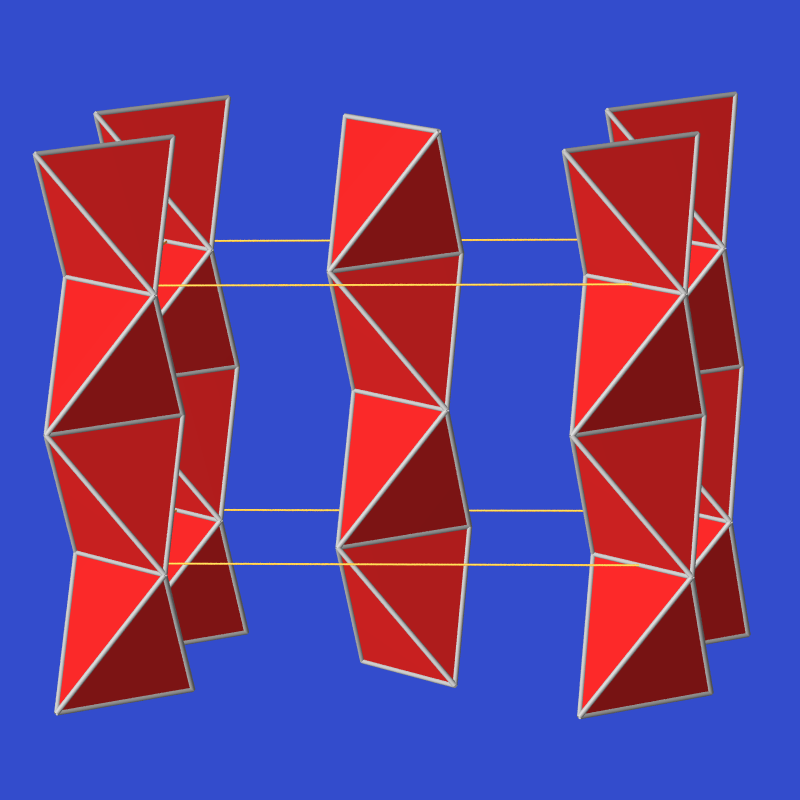
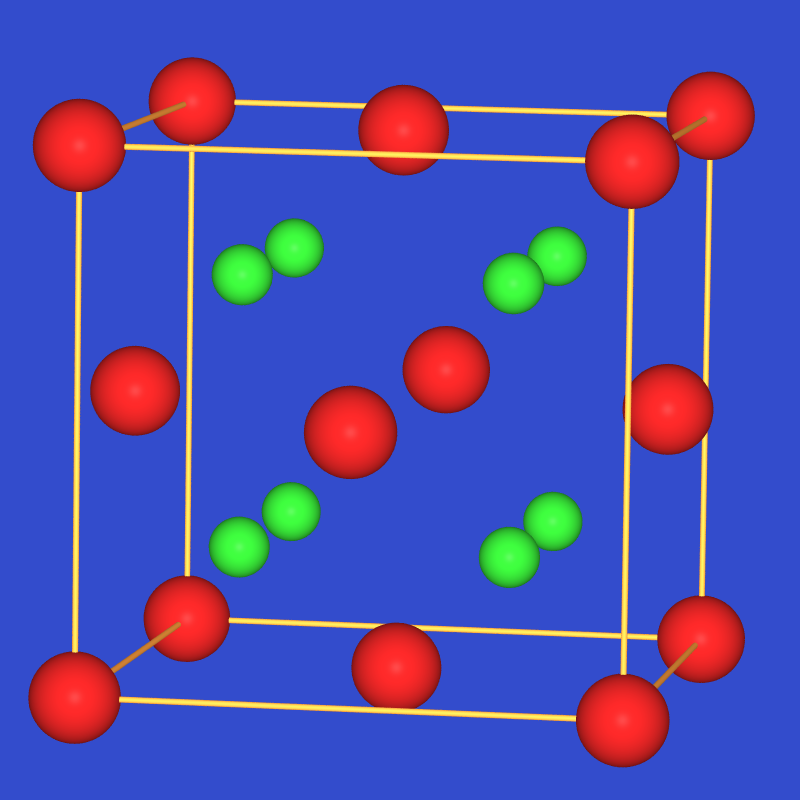
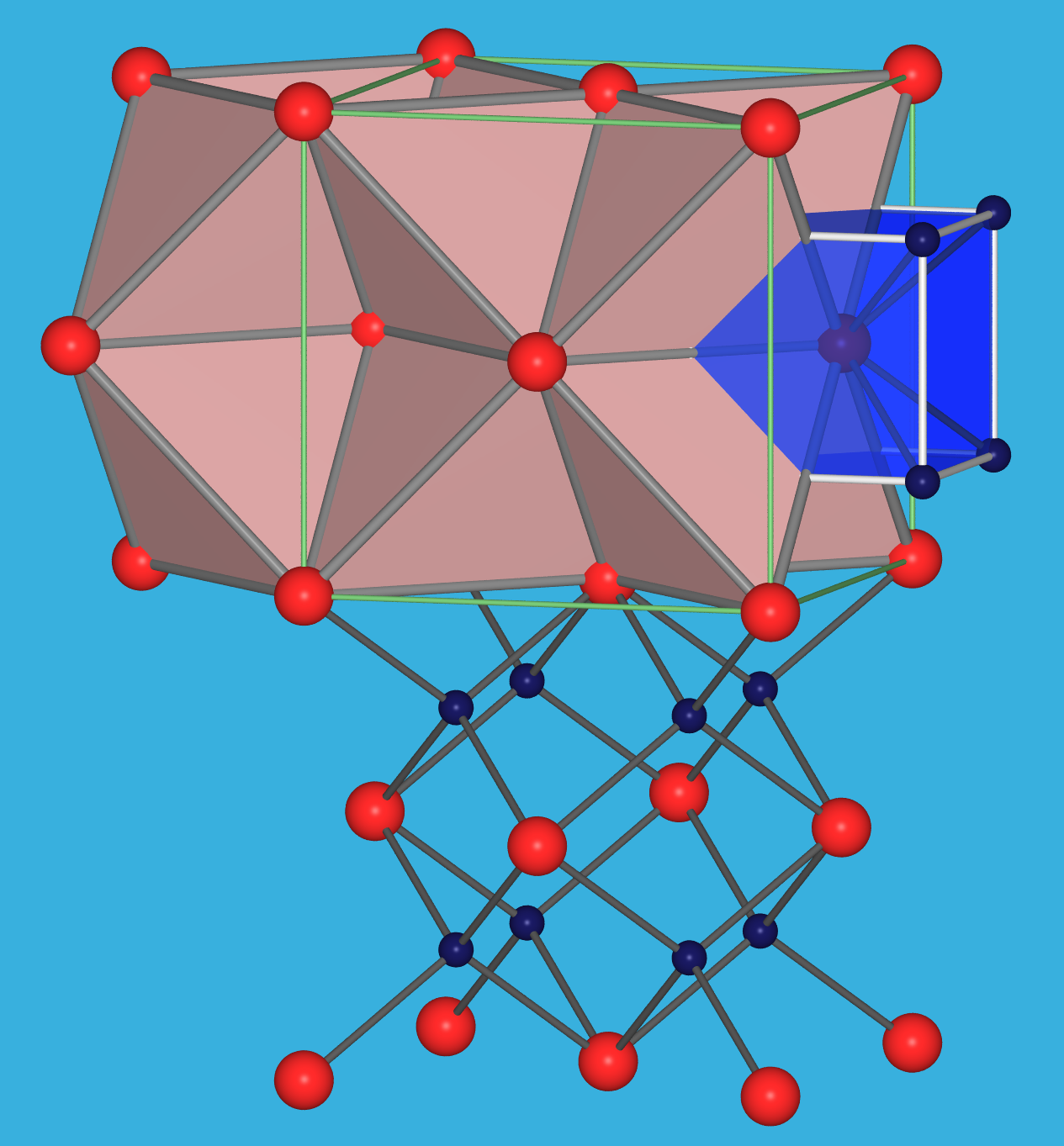
Einschub: Be als Aussenseiter
In der Reihe der Erdalkalimetalle nimmt Beryllium die Rolle eines Außenseiters ein. Dies liegt zum einen an dem relativ kleinen 'Ionenradius', Be2+ ist nur etwa halb so groß wie Mg2+. Darüberhinaus ist die Elektronegativität von Beryllium relativ groß, so dass eine ausgeprägte Tendenz zur Bildung kovalenter Bindungen besteht. In kovalenten Verbindungen erreicht Beryllium dabei die 8er-Schale (wie auch das Bor) nach drei verschiedenen Prinzipien:- Ausbildung von Zweielektronen-Dreizentren-Bindungen, z.B. in
Berylliumwasserstoff BeH2 oder Dimethylberyllium Be(CH3)2:
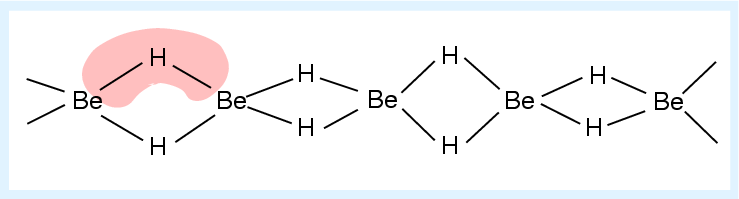
Abb. 3.3.1. Valenzstrichformel von BeH2 ‣SVG - Ausbildung von pπ-pπ-Bindung, z.B. in gasförmigem BeCl2 und in vielen
organischen Be-Verbindungen, die im Dampf ebenfalls dimer vorliegen.
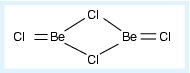
Abb. 3.3.2. Valenzstrichformel von BeCl2 (Gasphase) ‣SVG - Bildung von Lewis-Säure-Base-Addukten, z.B. in [BeCl4]2- oder in
festem BeCl2:
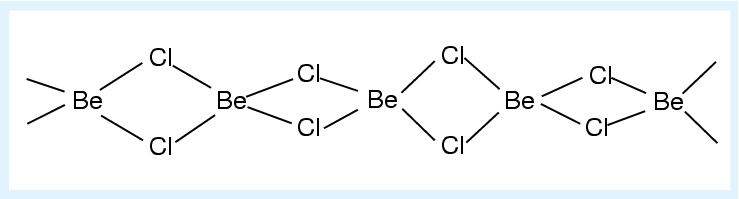
Abb. 3.3.2. Valenzstrichformel von BeCl2 (Feststoff) ‣SVG
| Li | Be | B | C |
| Na | Mg | Al | Si |
besteht, da hier ähnliche Verhältnisse Ladung/Radius (Ladungsdichten) vorliegen, zeigen diese Elementpaare einige Änlichkeiten. Z.B. liegt im Fall von Be2+ das Verhältnis bei 2/31 = 0.065 und ist damit sehr nahe am Ladung/Radius-Verhältnis von Al3+ (3/50 = 0.060). Entsprechend gibt es eine Reihe von Analogien zwischen Beryllium und Aluminium:
- Die Hydride beider Elemente sind hochpolymer.
- Die Chloride sind hydrolyseempfindlich.
- Die Oxide sind hart, hochschmelzend und säureunlöslich.
- Die Hydroxide sind amphoter.