| cr_home | Nichtmetalle | Strukturchemie | FK-Chemie | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Kap. 9 | Literatur | ⇨ |
| Al | Ga | In | Tl | |
|---|---|---|---|---|
| EN (Allred-Rochow) | 1.47 | 1.82 | 1.49 | 1.44 |
| E0 [V] | -1.68 | -0.53 | -0.34 | -0.34+I/+0.72+III |
| r[6]M3+ [pm] | 67.5 | 76 | 94 | 102.3 |
| r[12]M [pm] | 143.2 | 141.1 | 166.3 | 171.6 |
| Elemente | glänzende, an Luft stabile Metalle | luftempfindlich | ||
| Struktur | f.c.c. | eigener Typ | verz. b.c.c./f.c.c. | h.c.p. |
| Mp. [oC] | 660 | 30 | 156 | 302 |
| Darstellung | Schmelzfluss-Elektrolyse | Elektrolyse der Salzlösungen | ||
| Halogenide MX3 | MF3: ReO3-Struktur; AlCl3 Schichtstruktur; Rest und in Lsg./im Dampf: M2X6 | |||
| Oxide M2O3 | α- (Korund) und γ- (Hydrargillit) M2O3 | M2O3 und M2O | ||
| Hydroxide MOH3 | α- (Bayerit) und γ- (Gibbsit) M(OH)3 | . | ||
| Oxid-Hydroxide MOOH | α-MO(OH) (Diaspor) | . | ||
| Hydride MH3 | polymerer Feststoff | Dimere Moleküle | . | . |
| III-V-Verbindungen | III/V-Halbleiter | |||
| sonstige Verbindungen | MIMIII(SO4)2. 12 H2O (Alaune); MgAl2O4 (Spinell) | . | . | . |
| Flammenfarbe | keine | keine | blau (indigo) | grün |
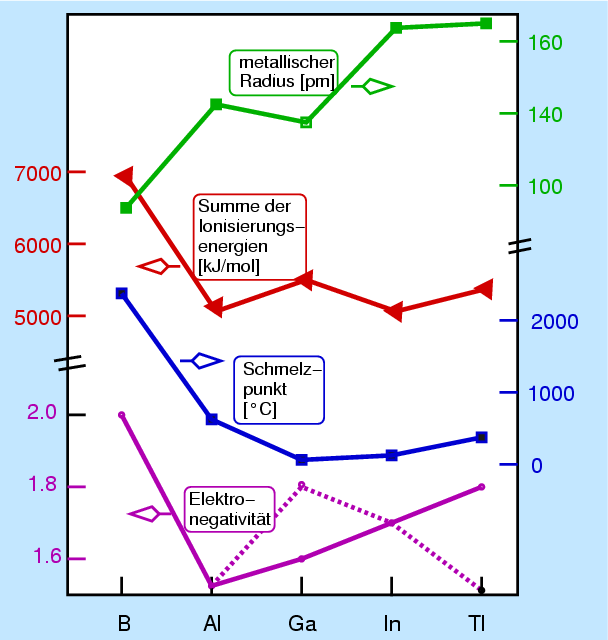
Gang in den physikalischer Eigenschaften: Im Unterschied zum ersten Element der Gruppe, dem Bor mit einem Schmelzpunkt von 2180 oC (kovalenter Festkörper), sind die Elemente Aluminium (Mp.=660 oC), Gallium (Mp.=29.8oC), Indium (Mp.=157oC) und Thallium (303oC) niedrig schmelzend (Minimum bei Gallium!). Alle sind typische, relativ weiche Metalle und gute elektrische Leiter.
 |
| Abb. 4.2.1. Tendenzen in der Gruppe der Triele ‣SVG |
Bei der Elektronegativität gibt es widersprüchliche Werte für Indium und Thallium: Die Werte nach der Allred-Rochow-Skala (Abb. 4.2.1. gestrichelte Linie) fallen vom hier sehr elektronegativem Gallium zum Thallium, nach der Pauling-Skala (Abb. 4.2.1. durchgezogene Linie) steigen sie in dieser Richtung. Die damit recht hohe Elektronegativität von Thallium zeigt sich zum Teil auch in der Chemie: Obwohl es sich um ein Element links der Zintl-Linie (Anionen-Kationen-Bildner) handelt, bildet es formal negative Tl- z.B. in NaTl. Andererseits bildet auch Gallium mit elektropositiven Partnern (z.B. mit Na, K usw.) Legierungen, deren Strukturen denen Bor-reicher Boride ähneln und in denen der kovalente Polyanionenverband nach den Wade-Regeln interpretiert werden kann (s. Kapitel 6.4. der Vorlesung Intermetallische Phasen).
Die Oxidationsstufe 3+ entspricht bei den Elementen dieser Gruppe der Edelgasschale, bei 1+ verbleibt eine gefüllte s-Schale (s2-Kationen). Wie bei allen Hauptgruppen nimmt nach unten die Tendenz zur Ausbildung der maximalen Oxidationsstufe ab, bei den Nebengruppen gilt das Umgekehrte. D.h. vom Gallium sind nur wenige Verbindungen mit einwertigem Element bekannt, bei Indium tritt +1 häufiger auf, Thallium ist fast ausschließlich einwertig.
In Tabelle 4.1.2. ist die Einordnung der Triel-Elemente in die Spannungsreihe gezeigt. Die metallischen Elemente der III. Hauptgruppe sind danach etwas 'edler' als die Erdalkalimetalle und etwa vergleichbar mit Zink oder Cadmium. Tl3+ hat bereits ein positives Redoxpotential, ist also ein Oxidationsmittel. In der Reihe der Triele ist Aluminium deutlich unedler als die übrigen Elemente.
| Element | oxidiert | reduziert | E [V] | |
| Fluor (F) | F2 | + 2e- ⟶ | 2 F- | +2.87 V |
| Sauerstoff | H2O2 + 2 H3O+ | + 2e- ⟶ | 4 H2O | +1.78 |
| Gold (Au) | Au+ | + e- ⟶ | Au | +1.69 V |
| Au3+ | + 3e- ⟶ | Au | +1.50 V | |
| Au3+ | + 2e- ⟶ | Au+ | +1.40 V | |
| Chlor (Cl) | Cl2 | + 2e- ⟶ | 2Cl- | +1.36 V |
| Brom (Br) | Br2 | + 2e- ⟶ | 2Br- | +1.07 V |
| Silber (Ag) | Ag+ | + e- ⟶ | Ag | +0.80 V |
| Eisen (Fe) | Fe3+ | + e- ⟶ | Fe2+ | +0.77 V |
| Thallium (Tl) | Tl3+ | + 3e- ⟶ | Tl | +0.72 V |
| Iod (I) | I2 | + 2e- ⟶ | 2I- | +0.53 V |
| Kupfer (Cu) | Cu+ | + e- ⟶ | Cu | +0.52 V |
| Cu2+ | + 2e- ⟶ | Cu | +0.34 V | |
| Cu2+ | + e- ⟶ | Cu+ | +0.16 V | |
| Wasserstoff (H) | 2H+ | + 2e- ⟶ | H2 | 0 V |
| Thallium (Tl) | Tl+ | + 1e- ⟶ | Tl | -0.34 V |
| Indium (In) | In3+ | + 3e- ⟶ | In | -0.34 V |
| Cadmium (Cd) | Cd2+ | + 2e- ⟶ | Cd | -0.40 V |
| Eisen (Fe) | Fe2+ | + 2e- ⟶ | Fe | -0.45 V |
| Gallium (Ga) | Ga3+ | + 3e- ⟶ | Ga | -0.53 V |
| Zink (Zn) | Zn2+ | + 2e- ⟶ | Zn | -0.76 V |
| Wasserstoff (H) | 2 H2O | + 2e- ⟶ | H2 + 2 OH- | -0.83 V |
| Aluminium (Al) | Al3+ | + 3e- ⟶ | Al | -1.66 V |
| Magnesium (Mg) | Mg2+ | + 2e- ⟶ | Mg | -2.37 V |
| Natrium (Na) | Na+ | + e- ⟶ | Na | -2.71 V |
| Lithium (Li) | Li+ | + e- ⟶ | Li | -3.04 V |
Die chemische Bindung in Verbindungen ist entweder ionisch (mit Nichtmetallen) bzw. metallisch (mit Metallen). In den wenigen bekannten kovalenten Verbindungen gelten dieselben Regeln wie für Bor oder Beryllium, d.h. das Oktett kann erreicht werden:
Vorkommen (‣SVG zu Elementhäufigkeiten in der Erdkruste)
Beim Vorkommen der Elemente kann zwischen dem wichtigstem Element dieser Gruppe, dem Aluminium, und den restlichen drei, technisch weniger wichtigen Metallen unterschieden werden:
 |
 |
 |
| Abb. 4.2.2. K[AlSi3O8] (Kalifeldspat) | Abb. 4.2.3. Muskovit-Glimmer (Al2[Si4O10](OH)2) usw. | Abb. 4.2.4. Bauxit |
| ⚗Flammenfärbung von Indium (8MB|MP4|H264) |
Thallium-Salze ergeben eine grüne Flamme (ebenfalls namensgebend: 'thallos' (gr.) = 'der grüne Zweig'). Die Farbe resultiert hier um den Übergang aus dem angeregten 7 2S1/2-Niveau in den 6 2P3/2-Zustand (535 nm). Der Übergang in den Grundzustand 6 2P1/2 liegt mit 377.6 nm im Ultravioletten.
| ⚗Flammenfärbung von Thallium (9MB|MP4|H264) |
| Element | Wikipedia | Webelements | Britannica | RSC |
|---|---|---|---|---|
| Aluminium | 🔗 | 🔗 | 🔗 | 🔗 | Gallium | 🔗 | 🔗 | 🔗 | 🔗 | Indium | 🔗 | 🔗 | 🔗 | 🔗 | Thallium | 🔗 | 🔗 | 🔗 | 🔗 |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Kap. 9 | Literatur | ⇨ |
| cr_home | Nichtmetalle | Strukturchemie | FK-Chemie | Interm. Phasen | Oxide | Silicate | Strukturtypen |