
| Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 |
| << Zusammensetzung M2O | Anfang Kap. 3.3.3 | Zusammensetzung M3O4 >> |
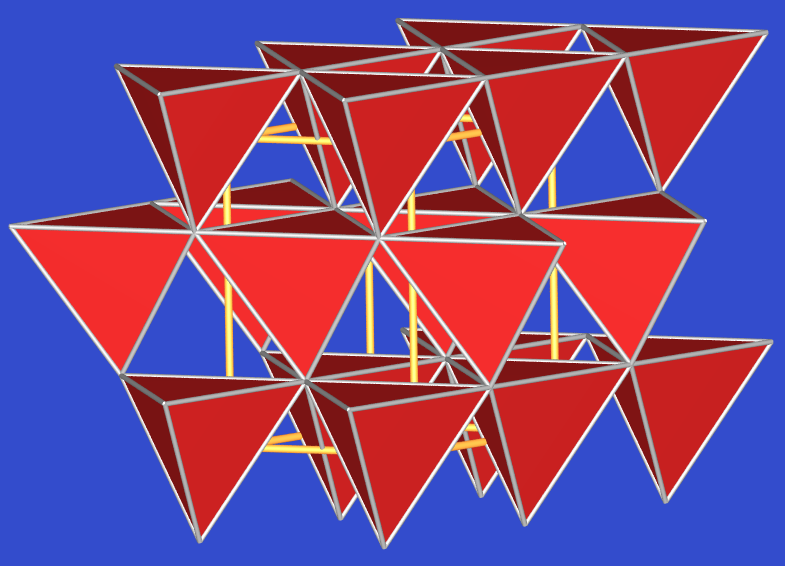
1. Ein großer Teil der Metalloxide MO läßt sich über dichteste Packungen erklären. Bei kleinen Kationen bzw. bei begünstigem tetraedrischem Ligandenfeld erfolgt die Füllung der Hälfte der Tetraederlücken, wobei allerdings von den beiden möglichen Strukturtypen (Zinkblende: f.c.c.-Basis, Wurtzit: h.c.p.-Basis) z.B. in BeO und ZnO nur der Wurtzit-Typ (s. Abb. 3.3.3.2.1) vorkommt (CN(O)=CN(M)=4).
 |
 |
| 3.3.3.2.1. Wurtzit-Struktur | 3.3.3.2.2. Zinkblende-Struktur |
2. Die meisten 1:1-Oxide besitzen Kochsalzstruktur, ( NaCl-Typ) d.h. es liegt eine f.c.c.-Packung der Oxid-Ionen, in der alle Oktaederlücken mit Kationen M besetzt sind. Die Oxide von Mg, Ca, Sr, Ba, Cd und Eu zeigen dabei volle NaCl-Symmetrie, während bei den Übergangsmetalloxiden (Ti-Ni) Abweichungen von der vollen Symmterie auftreten. Diese Abweichungen sind:
In den Oxiden der d9-Ionen, CuO (Tenorit) und AgO,
ist O2- tetraedrisch und das Metallion quadratisch planar
(Cu-O: 4*196 pm) koordiniert (s. Abb. 3.3.3.2.3.). In der Struktur sind
die Ketten kantenverknüpfter CuO4 jedoch so gegeneinander verkippt,
daß zwei weitere Sauerstoffatome zum Kupfer einen Abstand von 278 pm aufweisen
und alternativ auch von einem elongierten Oktaeder als Koordinationspolyeder
gesprochen werden kann.
d8-Ionen (Pd2+, Pt2+) bilden in den Oxiden
( PtS-Typ)
dagegen eine tetragonale Umgebung ohne weitere zusätzliche Sauerstoff-Koordination (Abb. 3.3.3.2.4.).
 |
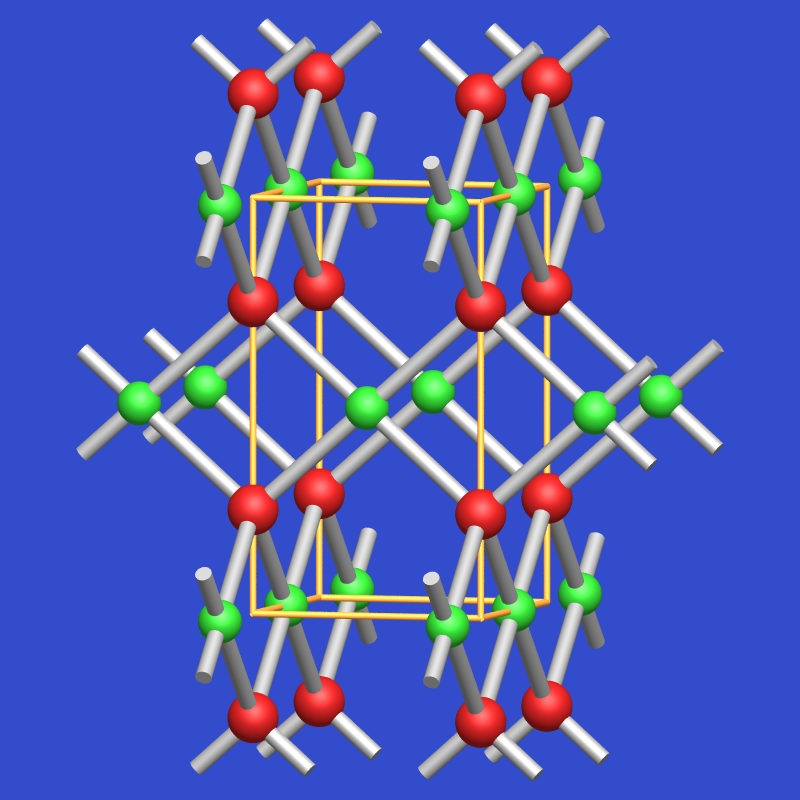 |
| 3.3.3.2.3. Struktur von CuO (Tenorit) | 3.3.3.2.4. PtO-Struktur |
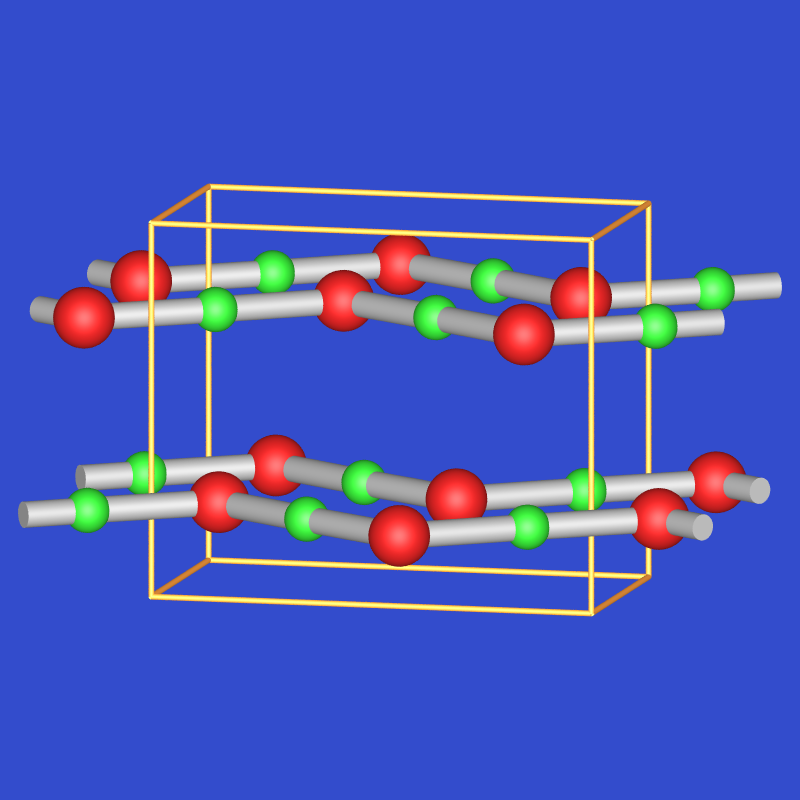
Quecksilber bevorzugt dagegen wie in seinen Komplexen eine lineare Koordination und bildet daher besondere Strukturtypen
aus: HgO ist dimorph und bildet eine stabile
rote, orthorhombische und eine metastabile
gelbe, trigonale Modifikation. Beide Phasen
enthalten Zick-Zack-Ketten O-Hg-O-Hg- mit einem Winkel von 107o
am Sauerstoff und linearer Umgebung am Quecksilber (CN = 2 + 4 = sehr stark verzerrtes Oktaeder).
Die Ketten sind in der orthorhombischen Form planar in der hexagonalen Form (HgS-Typ) geschraubt.
 |
 |
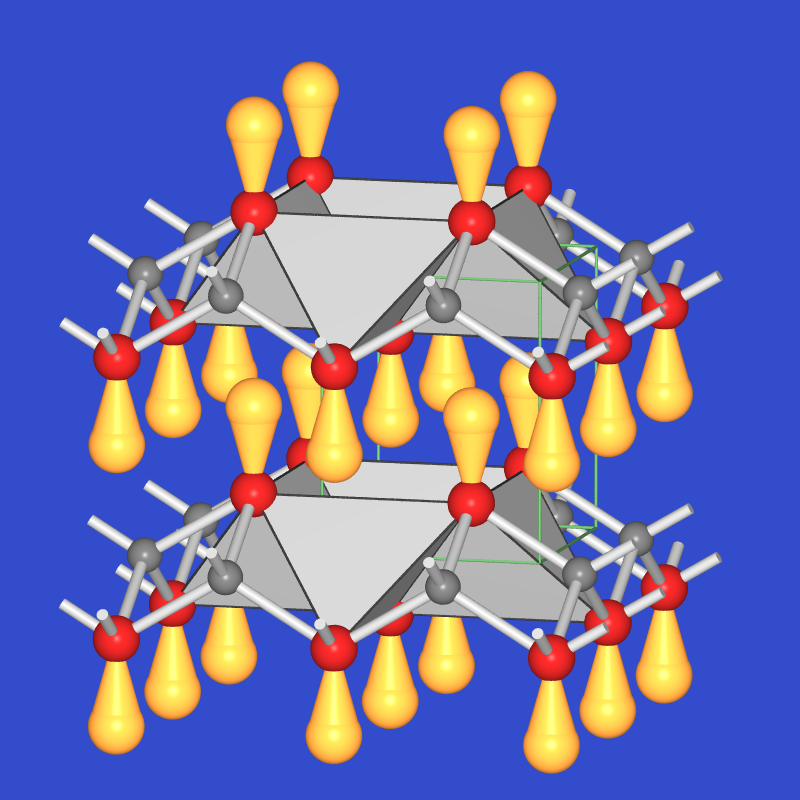 |
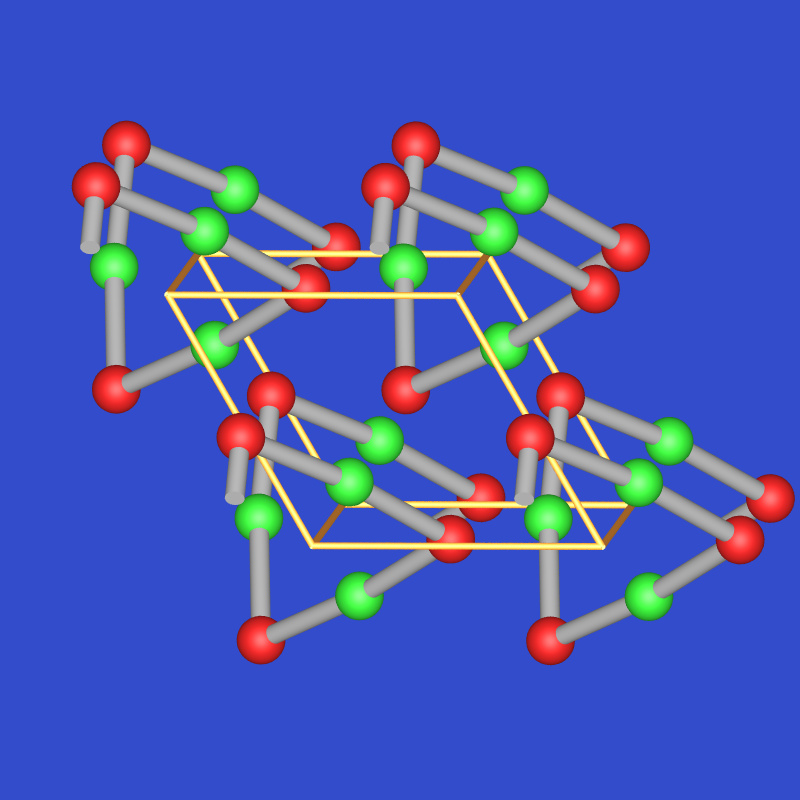
| 3.3.3.2.5. Struktur von rotem, orthorhombischen HgO | 3.3.3.2.6. Struktur von gelbem, trigonalen HgO | 3.3.3.2.7. Struktur von PbO |
4. Besondere Strukturen finden sich - ebenfalls aufgrund elektronischer Effekte - bei Ionen mit Inert Pair-Elektronen: SnO und PbO bilden verzerrte CsCl-Strukturen mit CN(O)=4 (verzerrt tetraedrisch) und CN(M) = 4 + 1 L.P (quadratische psi-Pyramide) (Abb. 3.3.3.2.7.). Die alternative Beschreibung der Struktur als Antityp mit einer kubisch dichtesten Packung der Pb-Atome, in der die Hälfte der Tetraederlücken mit Sauerstoff gefüllt ist, ist ebenfalls möglich.
| << Zusammensetzung M2O | Anfang Kap. 3.3.3 | Zusammensetzung M3O4 >> |
| Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 |