- GeO2 ist dimorph und bildet sowohl den Rutil- als auch die ß-Quarz-Modifikation.
Ge[6]O2 (Rutil) -- 1033oC ⟶ Ge[IV]O2 (Quarz) Im Vergleich zum SiO2 ist hier also der Rutil-Typ nicht die Hochdruck-, sondern die Niedertemperaturphase. - Die Monochalkogenide GeO, GeS, GeSe und GeTe sind alle bekannt. Es handelt sich um Isostere zu den Elementen der V. Hauptgruppe: Das Sulfid und das Selenid bilden gewellte Netze, die alternierend aus Germanium und dem Chalkogenen bestehen und denen im schwarzen Phosphor entsprechend. In GeTe liegen entsprechend gewellte Netze wie im grauen Arsen vor. Neben den einfachen Oxiden gibt es eine große Zahl komplexer Oxo-Verbindungen, die sich von GeO oder GeO2 durch formale Addition eines einfachen Metalloxids ableiten (sog. Oxo-Germanate). Die meisten dieser Verbindungen sind verwandt mit den entsprechenden Silicaten, einige Verbindungen des GeII entsprechen den entsprechenden Stannaten(II).
- SnIV-Verbindungen (Dichalkogenide)
- SnO2 (Kassiterit) hat Rutil-Struktur
und ist ein wichtigstes Zinn-Mineral. Es ist löslich in konzentrierter
Salzesäure:
SnO2 + 4 HCl ⟶ SnCl4 + 2 H2O Zusammen mit Alkali- und Erdalkalimetalloxiden gibt es eine große Zahl komplexer Sn[IV]-Verbindungen (Oxostannate(IV), wie z.B. Rb4SnO4, s.Acta C ). - Das ebenfalls aus der Analytik bekannte Disulfid SnS2 wird wegen seiner Farbe als Goldersatz z.B. für Bilderrahmen verwendet.
- SnO2 (Kassiterit) hat Rutil-Struktur
und ist ein wichtigstes Zinn-Mineral. Es ist löslich in konzentrierter
Salzesäure:
- SnII-Verbindungen (Monochalkogenide)
- Graues SnO bildet wie oben beschrieben
eine Überstruktur (Ordnungsvariante) des schwarzen Phosphros.
Zur Darstellung kann SnCl2 in einer Sodaschmelze umgesetzt werden:
Na2CO3 + SnCl2 ⟶ 2 NaCl + CO2 + SnO Wie oben für das Dioxid beschrieben, so leiten sich auch vom Monoxid durch formale Addition von Metalloxiden Oxostannate(II) (früher: 'Stannite') wie z.B. K4SnO3 ab, in dem ψ-Tetraeder SnO34- die stereochemische Aktivität des Lone-Pairs am Sn(II) verdeutlichen. Auch hydratisierte Verbindungen (d.h. Hydroxo-Stannate und -Stannite) wie z.b. Na2[Sn(OH)4] sind bekannt. Sn(II)-Verbindungen sind starke Reduktionsmittel, die z.B. Cu(II) zu elementarem Kupfer reduzieren können:Cu[II]SO4 + Na2[Sn(OH)4] + 2 H2O ⟶ Cu[0] + H2SO4 + Na2[Sn(OH)6] Sn(OH)2 ist amphoter:Fällung: SnCl2 + 2 NaOH ⟶ Sn(OH)2 + 2 NaCl Auflösung: Sn(OH)2 + 2 NaOH ⟶ Na2[Sn(OH)4] - SnS hat die Struktur des schwarzen Phosphors (CN=3) und ist aus der
Analytik bekannt, wo es beim Einleiten von H2S entsteht:
SnCl2 + H2S ⟶ SnS + 2 HCl - SnSe ist isotyp zu SnS (CN=3), beim SnTe findet man dagegen NaCl-Struktur.
- Neben den reinen Sn(II)- und Sn(IV)-Verbindungen gibt es eine Reihe gemischtvalenter Oxostannate (s. auch bei Blei unten).
- Graues SnO bildet wie oben beschrieben
eine Überstruktur (Ordnungsvariante) des schwarzen Phosphros.
Zur Darstellung kann SnCl2 in einer Sodaschmelze umgesetzt werden:
- PbO2 hat Rutil-Struktur.
Wie alle Pb(IV)-Verbindungen ist es eine starkes Oxidationsmittel, daß z.B.
Iodid zu Iod
PbO2 + 2 HI + 2 HNO3 ⟶ 2 H2O + Pb(NO3)2 + I2 oder Nitrit zu Nitrat oxidiert:PbO2 + HNO2 + HNO3 ⟶ Pb(NO3)2 + H2O - Pb12O19 und Pb12O17 sind schwarz und kristallisieren in einer Defekt-CaF2-Struktur (z.B. für die erste Verbindung formulierbar als Pb24O38_24).
- Pb3O4 (Mennige) ist leuchtend orange-rot und wird als Pigment
(Grundierungsanstrich, Rostschutz) verwendet.
Bei Behandlung mit HNO3 entstehen lösliche Pb(II)-Salze und das schwerlösliche Dioxid:
Abb. 5.4.1. Mennige Pb2[PbO4] + 4 HNO3 ⟶ 2 Pb(NO3)2 + PbO2 + 2 H2O Die Verbindung kristallisiert nicht im Spinelltyp, sondern bildet, da mit Pb(II) ein Lone-Pair-Kation vorkommt, einen eigenen Strukturtyp aus: Wie Abbildung 5.4.2. zeigt, sind Oktaeder [Pb[IV]O6] (rot) über Kanten zu Ketten [PbIVO2O4/2] verknüpft, die von dreibindigen Pb[II]-Kationen (rote Kugeln) in ψ-tetraederischer Umgebung von Sauerstoff (blaue Kugeln) weiter kondensiert sind.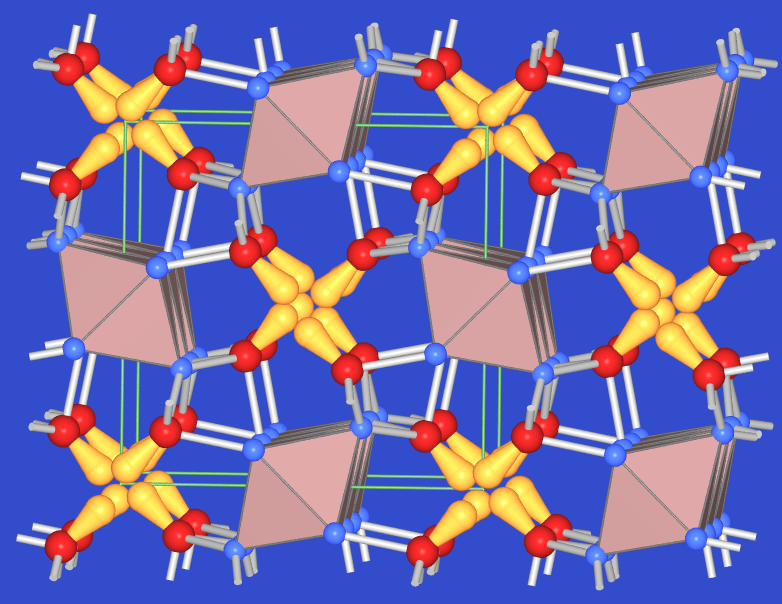
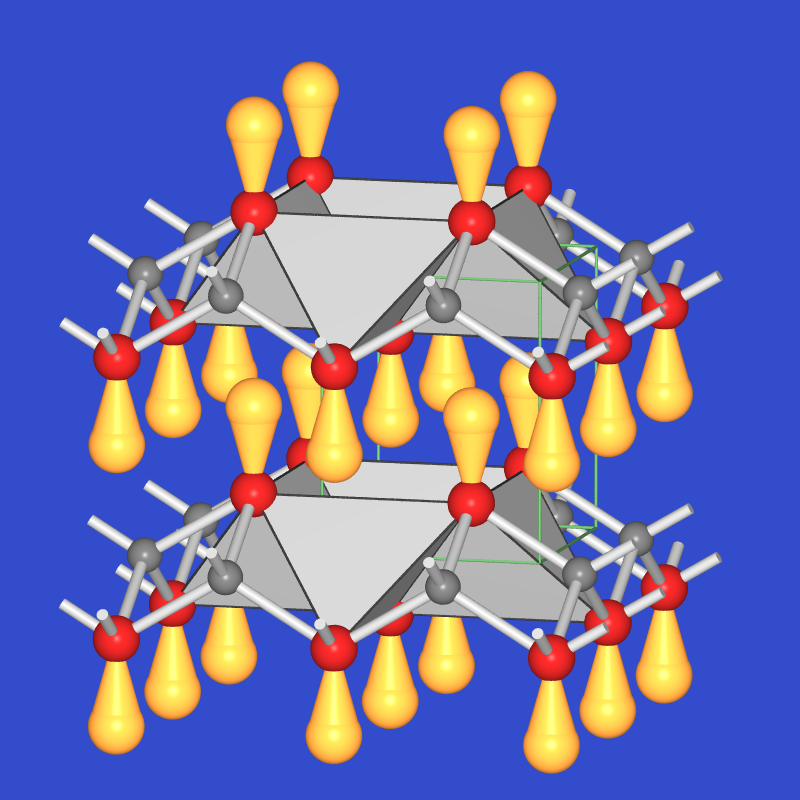
Abb. 5.4.2. Struktur und Foto von Mennige ‣VRML Abb. 5.4.3. Struktur von PbO ‣VRML - PbO tritt in verschiedenen Modifikationen auf:
- Die Struktur der tetragonalen rote Formn (des sogenannte Bleiockers) kann von der CsCl-Struktur abgeleitet werden, in dem die Zentren der Elementarzelle (Cs-Atome) verschoben werden (Abb. 5.4.3.), so dass wieder die stereochemische Aktivität des nichtbindenden Elektronenpaares deutlich wird.
- Die orthorhombische gelbe Form (Massicot) ist eine Hochtemperaturphase mit Pb-O-Pb-Ketten.
- 2 weitere Modifikationen (graue Blättchen bzw. grau feinkristallin
Ausfällen: Pb(NO3)2 + 2 NaOH ⟶ Pb(OH)2 + 2 NaNO3 Auflösen: Pb(OH)2 + 2 NaOH ⟶ Na2[Pb(OH)4] Pb[II] ist - im Gegensatz zu Sn[II] - kein Reduktionsmittel und wird z.B. von elementarem Brom zu Blei(IV) oxidiert:Na2[Pb(OH)4] + Br2 ⟶ 2 NaBr + PbO2+ 2 H2O - Zusätzlich zum obigen Schema gibt es auch ein metastabiles Sesquioxid Pb2O3.
Das Mono-Sulfid von Blei ist aus der Analytik (Fällung von PbS)