Vorlesung Chemie der Metalle
9. Übergangsmetalle II
I. Nebengruppe/11. Gruppe/Cu-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel: (im Aufbau, bisher nur Materialien)
- Allgemeines
- Kupfer
- Element, Vorkommen und Gewinnung
- Versuche
- weitere Abbildungen
- Silber
- Element, Vorkommen und Gewinnung
- Gold
- Element, Vorkommen und Gewinnung
- einige Gold-Verbindungen (nach Oxidationsstufen, VRMLs)
Allgemeines
Zur I. Nebengruppe, 11. Gruppe oder Cu-Gruppe gehören die
Elemente Kupfer (Cu, englisch copper), Silber (Ag) und Gold (Au).
Diese drei Elemente werden auch als 'Münzmetalle' zusammengefasst,
da sie aufgrund ihres edlen Charakters
[Standardpotentiale: +0.32 V (Cu/Cu2+), +0.80 V (Ag/Ag+ und
+1.50 V (Au/Au3+)]
als Zahlungsmittel verwendet wurden.
Alle drei Elemente sind gute elektrische und Wärme-Leiter mit
Schmelzpunkten um 1000 oC. Die Elemente sind duktil
und kristallisieren im Cu-Typ/f.c.c..
Die wichtigsten Oxidationsstufen (z.B. in wässriger Lösung)
ändern sich von +II bei Kupfer, +I bei Silber und +III
beim Gold hier etwas ungewöhnlich.
Kupfer
Element: Vorkommen, Gewinnung, Eigenschaften
Diesen Abschnitt gibt es aus dem SS 2018 auch als
PDF-Präsentation.
Für die Herstellung von Kupfer gibt es drei wichtige Rohstoffquellen:
- 85 % aller verwendeten Erze sind Sulfide. Zu nennen sind hier die
Fe-haltige Cu-Erze wie Kupferkies CuFeS2 (Abb. 9.1.1.),
Buntkupferkies Cu5FeS4, die
vor allem in den USA und in Kanada abgebaut werden. Allerdings enthalten alle Erze
viel Gangart, der Cu-Gehalt liegt lediglich bei 0.6 bis 5 %.
Aus diesen Erzen wird Kupfer nach dem sog. pyrometallurgische Verfahren (s.u.) gewonnen.

|
| 9.1.1. Kupferkies, eines der wichtigsten Cu-Minerale |
- Ein Cu-haltiges Oxid ist der Malachit,
Cu2(OH)2(CO3, (Abb. 9.1.2. Links und Mitte) sowie das
sogenannte Rotkupfererz (auch Cuprit), Cu2O (Abb. 9.1.2. rechts).
Diese Erze werden für die hydrometallurgischen Verfahren verwendet, die heute
von untergeordneter Bedeutung sind. Hierbei werden Cu-arme Erze und Cu-haltige Abfallmaterialien
in H2SO4 bei Anwesenheit von Fe3+ gelöst, so dass
eine Cu2+-Lösung entsteht. Aus dieser wird elementares Kupfer durch
Gewinnungselektrolyse erhalten.
 |
 |
 |
| Malachit |
Malachit mit Azurit |
Cuprit |
| 9.1.2. Weitere Cu-Minerale |
- Aus Cu-Schrott (der Cu-Rücklauf liegt derzeit bei ca. 50 %) wird durch
Raffination, d.h. lediglich Reinigung, ebenfalls eine erhebliche Menge Kupfer
wiederverwendet.
Das folgende Schema (Abb. 9.1.3.) zeigt die Gewinnung von Cu-Kathoden ausgehend von den
drei verschiedenen Rohstoffgruppen:
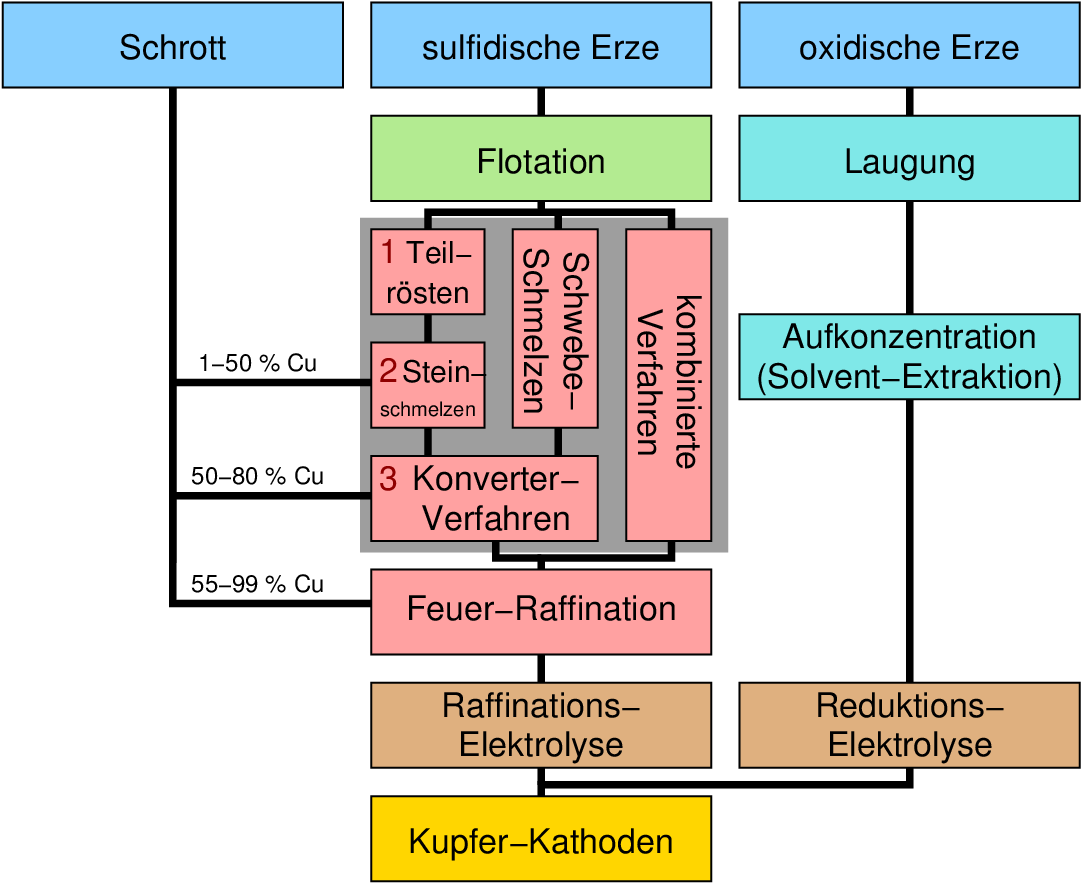 |
| Abb. 9.1.3.
Gesamtschema Cu-Herstellung
‣SVG
|
Wichtig ist derzeit vor allem die Herstellung ausgehend von den Sulfiden (Abb. 9.1.3. Mitte), die ca. 75-80 % der
Weltproduktion an Neu-Kupfer ausmacht. In Abbildung 9.1.4. ist das Gesamtschema der
klassischen pyrometallurgischen Kupferherstellung gezeigt.
Neue Entwicklungen
vereinfachen das Verfahren etwas, indem mehrere Prozessschritt in einem
Ofen durchgeführt werden (KIVCET-Verfahren, Mitsubishi-Prozess etc.,
s. graue Unterlegung in Abb. 9.1.3.).
Dies macht die Anlagen jedoch weniger flexibel was den jeweils verfügbaren Rohstoff
und das Cu-Recycling betrifft
(s. auch PDF-Präsentation dazu).
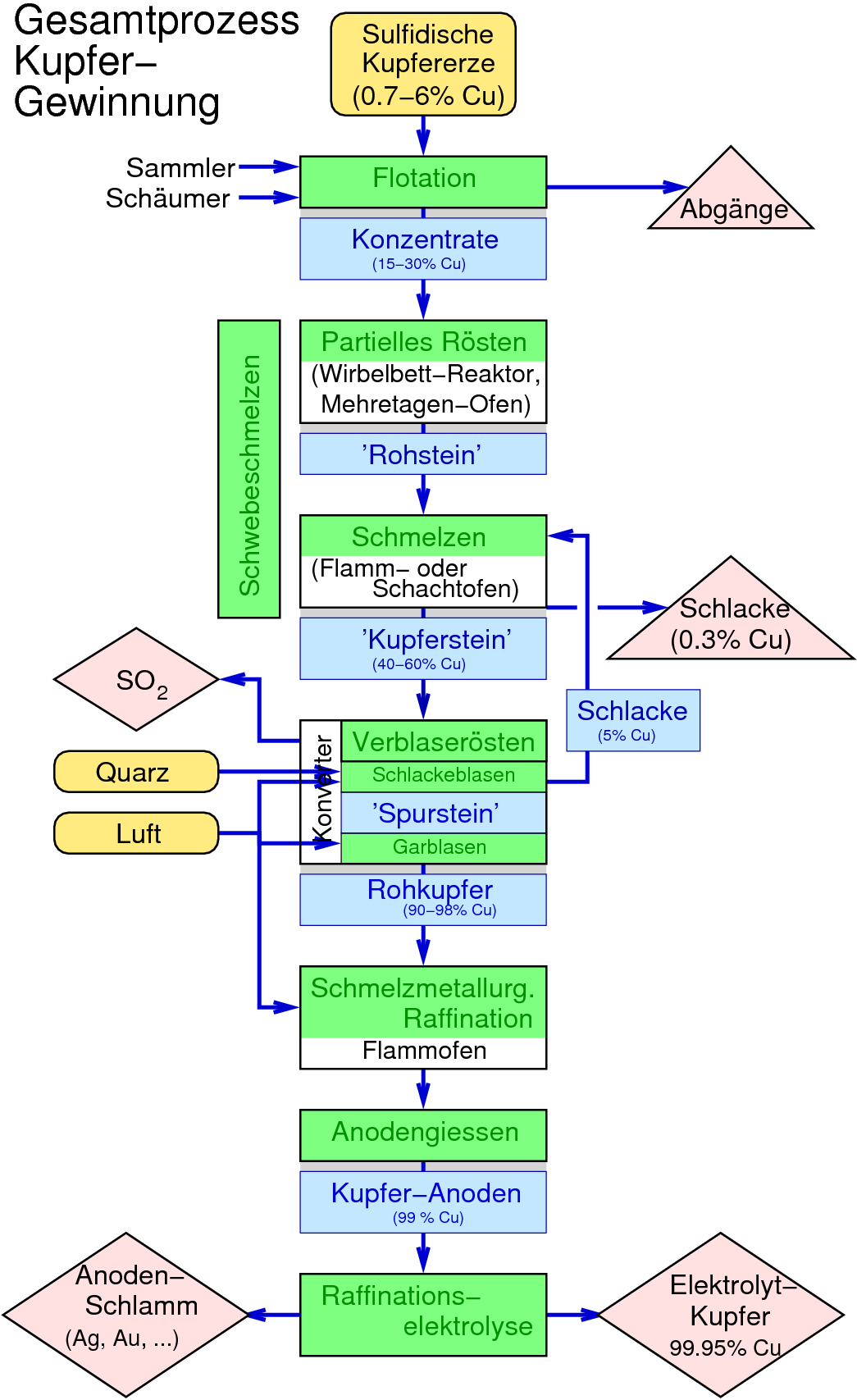 |
| Abb. 9.1.4.
Gesamtschema der pyrometallurischen Primär-Kupfer-Herstellung
‣SVG
|
Beim Röstreaktionsverfahren wird zuerst das Eisen in mehreren Schritten abgetrennt:
- Durch Schaum-Flotation,
die in Flotationszellen (s. Abb. 9.1.5.)
durchgeführt wird,
wird eine Anreicherung der Cu-Erze bzw. eine Abtrennung
von der Gangart erreicht.
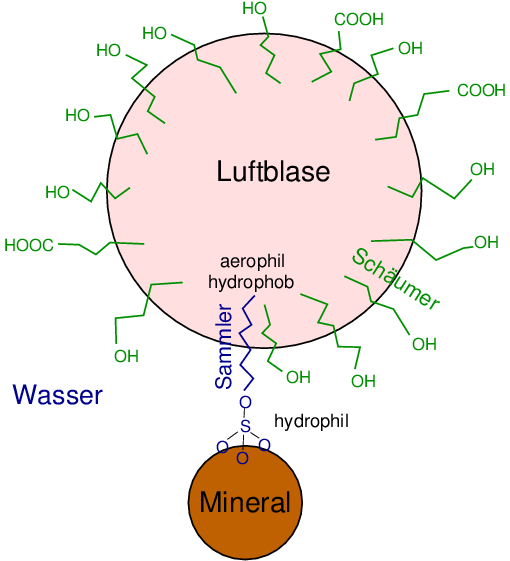
Dabei werden sog. Sammler wie z.B. Xantogenate genutzt, die sich
selektiv an die sulfidischen Minerale heften (blau in Abb. 9.1.5. links).
Deren lange Alkylketten bilden gemeinsam mit den Schäumern (grün)
(ggf. + 'Drücker' und 'Beleber' zur Schaumsteuerung) die
Membranen um Luftblasen. Diese Mineral-beladenen Luftblasen
werden dann in Flotationszellen, wie in Abb. 9.1.5. rechts gezeigt,
abgetrennt.
 |
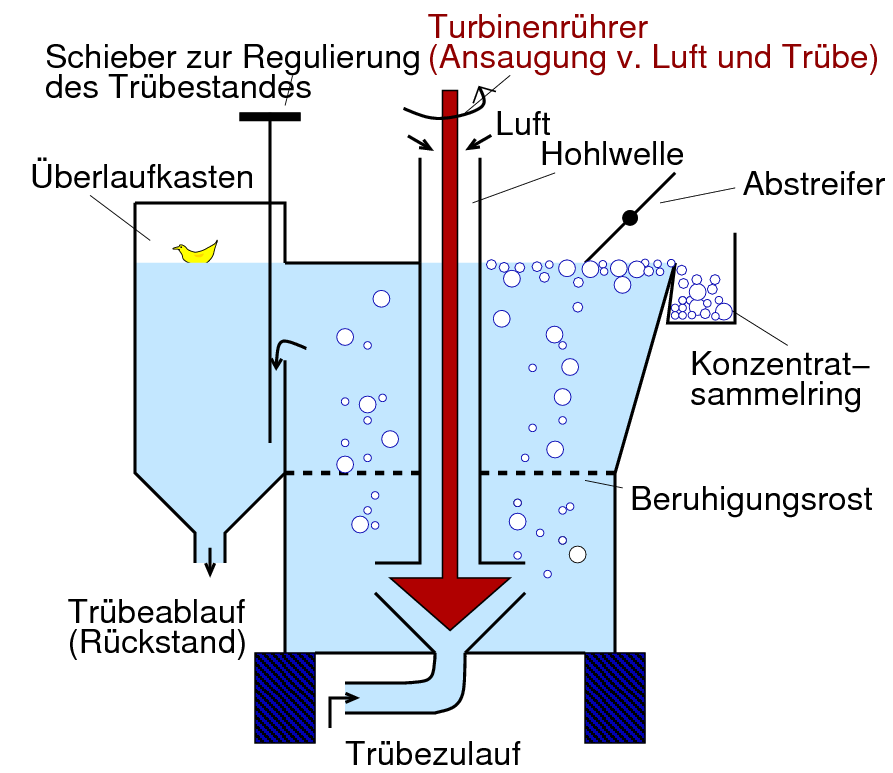 |
| Abb. 9.1.5.
Prinzip der Flotation (links)
‣SVG
und Flotationszelle (rechts)
‣SVG
|
- Durch Oxidation (partielles Rösten, Teilrösten im Röstofen, meist
einem Wirbelbett-Reaktor (s. Abb. 9.1.6)
wird Fe-Sulfid mit Sauerstoff bei 700 bis 800 oC zu Fe(II)-Oxid umgesetzt
CuFeS2 + O2 ⟶ Cu2S + FeO + SO2
Das entstehende Schwefeldioxid kann für die Herstellung von H2SO4 weiterverwendet werden.
Die festen Produkte dieses Prozesses nennt man Röststein, eine Mischung aus
Cu2S, FeS und FeO.
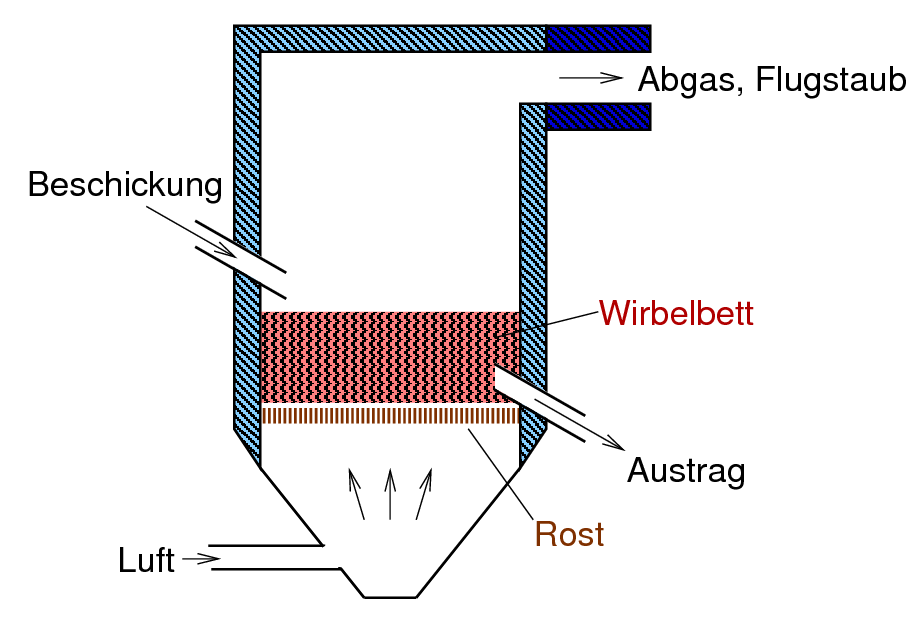 |
| Abb. 9.1.6.
Prinzip des Wirbelbettreaktors
‣SVG
|
- Anschließend wird das Fe-Oxid im Flammofen (s. Abb. 9.1.7)
mit Siliciumdioxid verschlackt:
2 FeO + SiO2 ⟶ Fe2SiO4
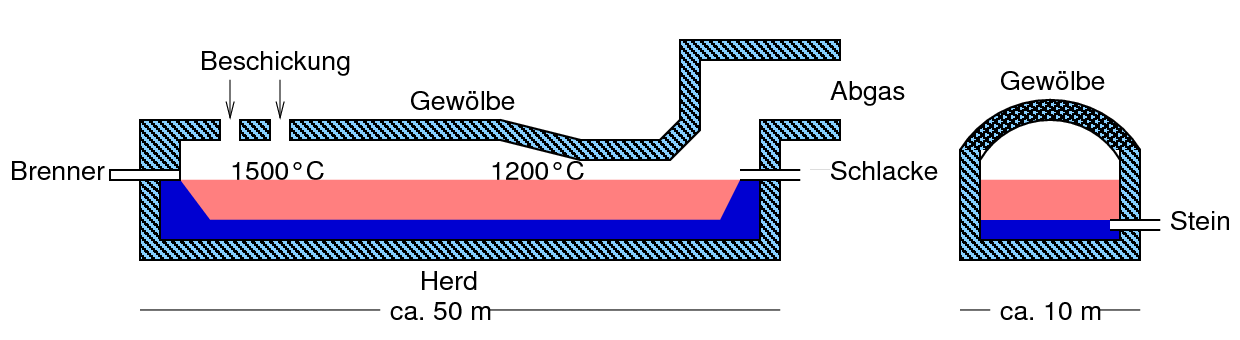 |
| Abb. 9.1.7.
Flammofen
‣SVG
|
Das Produkt dieses Prozesses heißt Kupferstein (Cu2S mit FeS).
Als weitere Schritte folgen in einem kippbaren Konverter
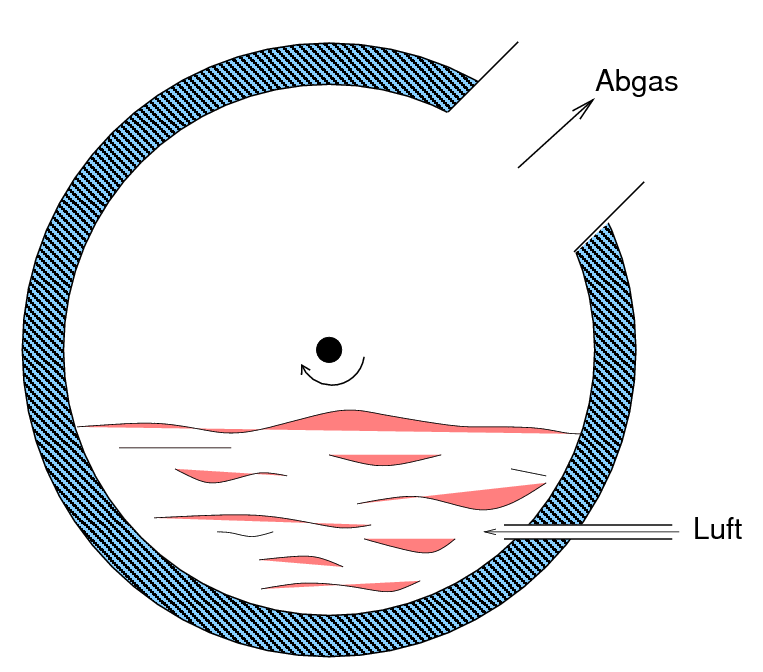 |
| Abb. 9.1.8.
Konverter
‣SVG
|
- Beim Verblaserösten wird noch das restliche FeS geröstet
FeS + 3/2 O2 ⟶ FeO + SO2
und dann verschlackt:
2 FeO + SiO2 ⟶ Fe2SiO4
Nach ca. einer Stunde ist das Eisen verschlackt und die Schlacke wird durch Kippen des Konverters abgegossen.
Das Produkt nach dem Verblaserösten nennt man Spurstein (Cu2S).
- In einer Röstreaktion, dem sogenannten Garblasen wird das Cu-Sulfid
zu 2/3 zu Cu2O abgeröstet:
2 Cu2S + 3 O2 ⟶ 2 Cu2O + 2 SO2
Diese Röstung ist exotherm. Anschließend wird in einer als Reaktion bezeichneten 2. Teilreaktion elementares
Kupfer gewonnen:
Cu2S + 2 Cu2O ⟶ 6 Cu + SO2
Das Produkt dieser beiden Teilschritte (Röstreaktion) heißt Blasenkupfer oder Rohkupfer.
- Das Rohkupfer wird aus dem Konverter in Blöcke gegossen, die als Anodenplatten bei
- der Elektrolyse in CuSO4-Lösung dienen.
Das Produkt der elektrolytischen Reinung heißt Reinkupfer oder Elektrolytkupfer.
Bei der Elektrolyse (s. Abb. 9.1.9.) gehen unedle Metalle in Lösung, die als Begleiter des Kupfers
vorkommenden Edelmetalle wie Ag, Au oder Pt fallen von der Anode ab (Anodenschlamm)
und sind wesentlicher Rentabilitätsfaktor der Cu-Herstellung.
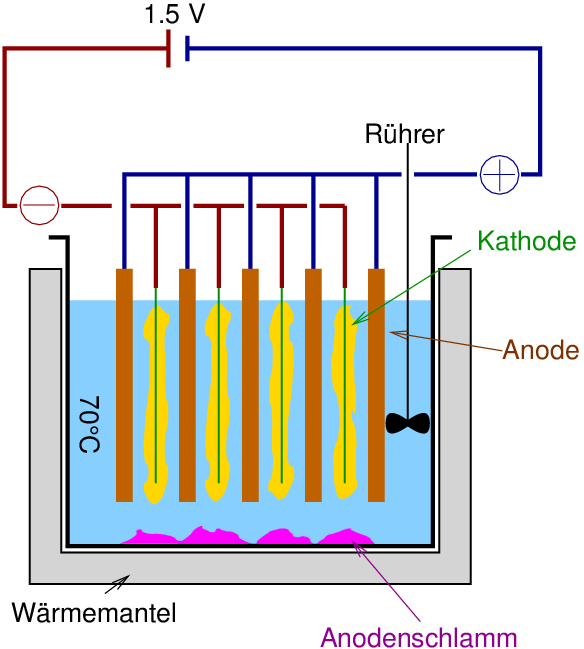 |
| Abb. 9.1.9.
Elektrolyse von Kupfer
‣SVG
|
- Der Preis für Rohkupfer lag am 13.7.2004 bei 2.3 Euro/kg, am 29.7.2011 bei 6.8 Euro/kg
und am 10.7.2020 bei 5.6 Euro/kg.
- Die Weltjahreproduktion an Primärkupfer betrug 2018 ca. 10 000 000 t (10 Millionen Tonnen).
Eine etwa vergleichbare Menge wurde durch Aufarbeitung von Cu-Schrott erhalten.
60 % des Primärkupfers werden von den vier Hauptproduzenten
Freeport-McMoRanu (Indonesien), BHP Billiton (Australien), Codelco (Chile)
und Glenscore (Schweiz) produziert.
Kupfer wird wegen seiner besonderen Eigenschaften,
- der guten elektronischen Leitfähigkeit,
- der guten Wärmeleitfähigkeit und
- der guten Oxidationsbeständigkeit
vielfach verwendet. Wichtige Cu-Legierungen sind Messing und die verschiedenen Bronzen
(zu Phasendiagrammen und Strukturchemie)
- Messing: Cu-Zn-Legierungen
- Bronze: Cu-Sn-Legierungen
- Bleibronzen: Cu-Pb-Legierungen (Gleitwerkstoffe, Lagermetall)
- Aluminiumbronzen: 5-12 % Al (besonders hart und zäh, Verwendung für Uhrfedern usw.)
- Nickelbronzen (z.B. Konstantan: 60 % Cu, 40 % Ni, T-unabhängige Leitfähigkeit)
 |
 |
| 9.1.10. Kupfer und Kupferlegierungen
(Dank an unsere Werkstatt!) |
| ⚗ Geld fälschen (Cu/Zn-Legierungen)
(34MB|MP4|H264) |
|
|
Das seit 1830 bekannte Experiment 'Golden Penny':
Im stark alkalischen und bei Anwesenheit von viel elementarem Zink entsteht
in der Hitze 'Weissmessing', eine Zn-reiche Cu-Legierung, auf der Oberfläche
eines Cu-Cents ('Silber'). Nach starkem Erhitzen diffundiert das Zink weiter ins Innere des Cents und es
bildet sich oberflächlich wieder ein Cu-reicheres Messing (Rotmessing)
('Gold', vgl. 'CuZn39' in Abb. 9.1.10. oben rechts).
|
Links zur Kupferherstellung:
Versuche zu Kupfer
Zu den beiden wichtigsten Oxidationsstufen von Kupfer, in wässriger Lösung
+II (d9), im Festkörper auch +I, haben/hatten wir zwei Versuche:
| ⚗ 'Kupferjodür' (aus der Cu-Eingangsstunde)
(29MB|MP4|H264) |
|
|
s. Erklärung im Video
|
sowie die aus der OC auch gekannte 'Fehling-Probe' auf reduzierende Zucker,
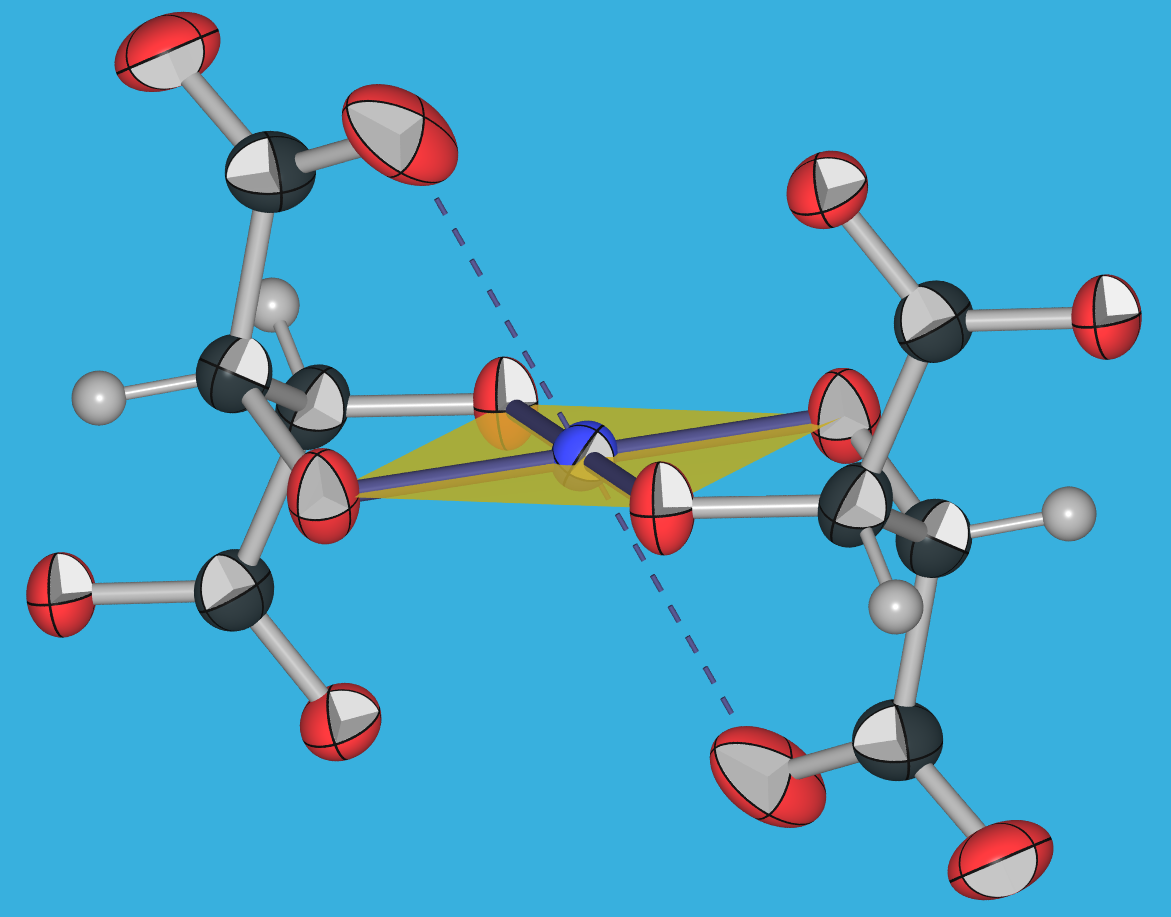
bei der Cu(II) (blaue Lösung des Ditartrato-Komplexes, Struktur s. Abb. 9.1.11) zu Cu(I)
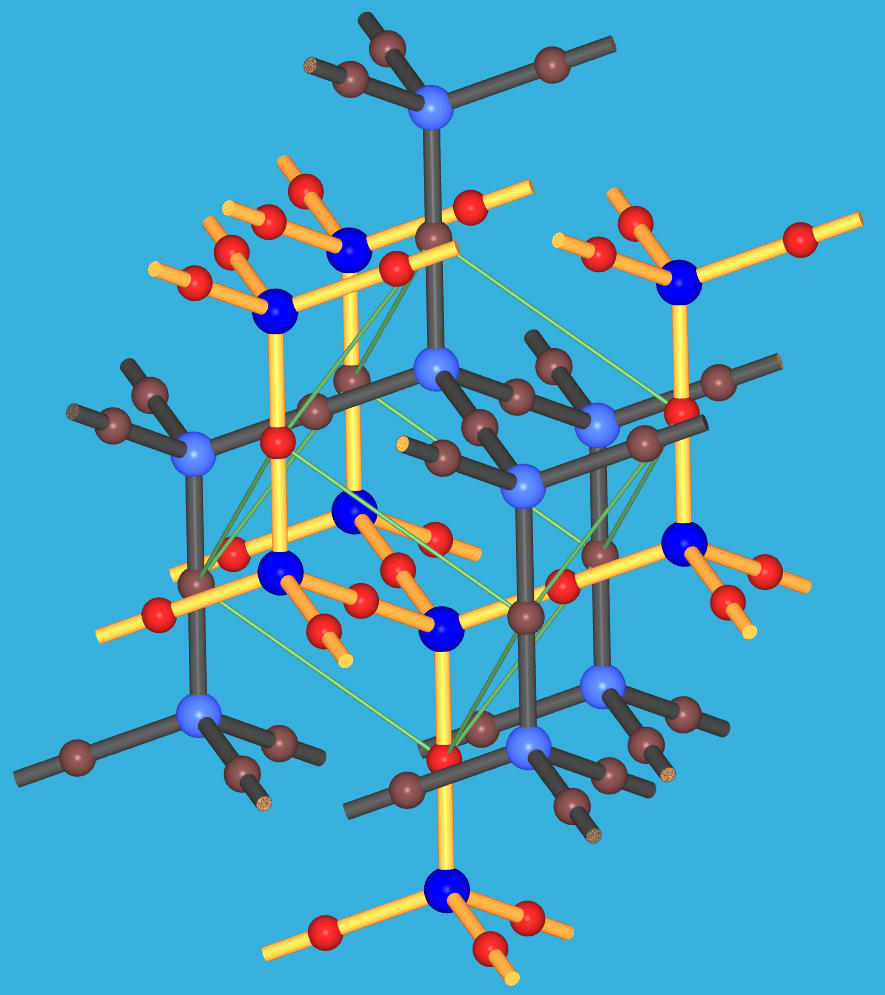
(Cuprit, Cu2O, rotbrauner Niederschlag, Struktur s. Abb. 9.1.12) reduziert wird.
| ⚗ 'Fehling-Probe'
(26MB|MP4|H264) |
|
|
Reduktion von Cu(II) zu Cu(I), Cuprit
|
 |
 |
| 9.1.11. Struktur des
Ditartrato-Komplexes von Cu(II) (s. Fehling-Probe)
‣VRML
|
9.1.12. Struktur
von Cuprit, Cu2O (s. Fehling-Probe;
die Struktur besteht auch zwei kristallographisch
äquivalenten Teilverbänden, die sich durchdringen!
Diese beiden Teilstrukturen sind farblich gekennzeichnet:
O: dunkel/hellblau; Cu: rot/rotbraun)
‣VRML
|
Cu(III)
| ⚗ Versuchsvideo 'Supraleiter'
(2.5MB|MP4|H264) |
|
|
Der Meissner-Ochsenfeld-Effekt von 1-2-3-Supraleitern (schwarze Pille unten)
|
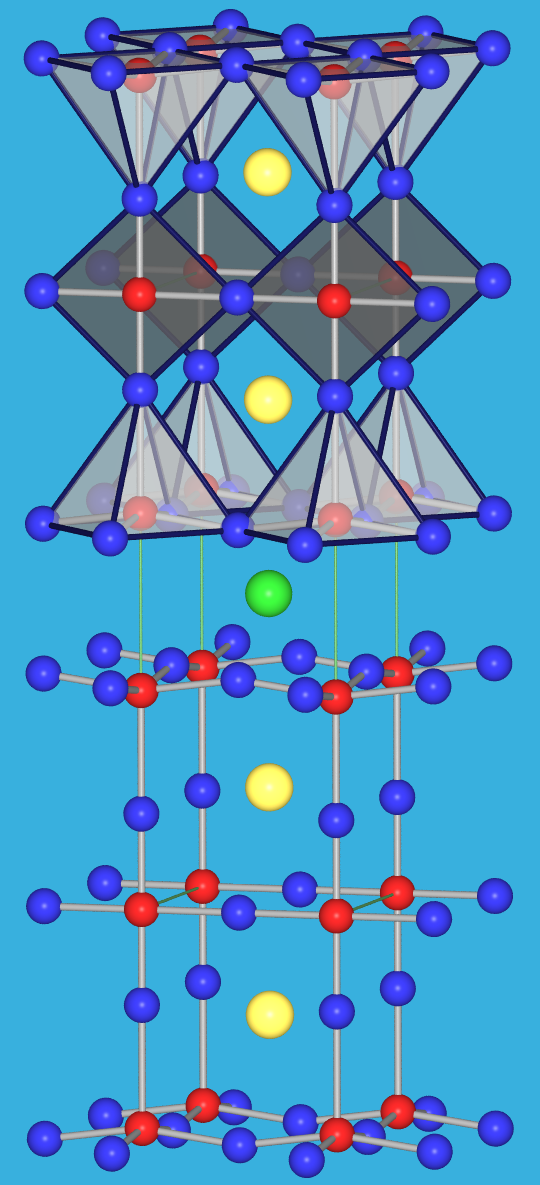 |
| 9.1.13. Struktur von
1-2-3-Supraleitern
‣VRML
|
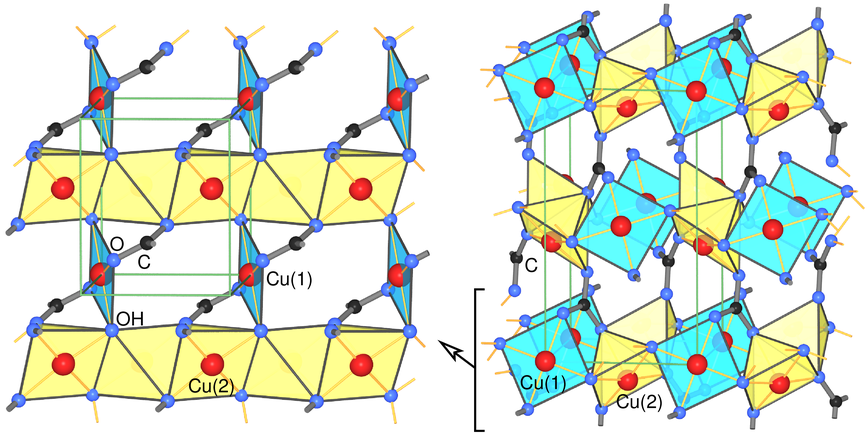
Fotos und Strukturen weiterer Cu-Verbindungen
 |
 |
| 9.1.9. Foto und Struktur von
Ägyptisch Blau
‣VRML
|
 |
 |
| 9.1.9. Struktur von
Azurit
‣VRML
|
9.1.X. Brilliant-Blau K
|
Silber
Element: Vorkommen, Gewinnung, Eigenschaften
 |
 |
| 9.1.XX Silber-Blech (links) und ein Tiegel aus Silber |
- Der Preis von Silber betrug am 10.7.2020 531 Euro/kg.
Gold
Element: Vorkommen, Gewinnung, Eigenschaften
- Zur Gold-Gewinnung gibt es aus dem WS 2013 eine
PDF-Präsentation (Oberseminar LA)
- Der Goldpreis lag am 10.7.2020 bei 51.2 Euro/g.
- einige externe Links:
- eigene Fotos
 |
| 9.1.XX Elementares Gold: einige Nuggets
und ein Blech |
Au-Verbindungen
nach fallenden Oxidationsstufen (nur VRMLs jeweils)
- Au+V (d6): Die höchste Oxidationsstufe
von Gold, +V, wird nur mit sehr harten Liganden, also in den Fluoriden
und Fluorido-Komplexen erreicht. Da Gold als 5d-Element eine große
Ligandenfeldaufspaltung bewirkt, handelt es sich durchweg um
oktaedrische, diamagnentische LS-d6-Systeme:
- Au2F10 enthält Dimere aus zwei
kanten-verknüpfter [AuF6]-Oktaedern (rote Polyeder: [AuF6]-Oktaeder).
- In [Xe2F11][AuF6]
konnte das einfache, oktaedrisch gebaute Hexafluorido-Aurat(V) stabilisiert werden (rote Polyeder: [AuF6]--Oktaeder; schwarze Kugeln: Xe; rote Kugeln: F).
- Au+III ist ein typisches d8-System
eines schweren Übergangsmetalls, d.h. die einfachen Verbindungen und auch alle
Komplexe mit Gold in der Oxidationsstufe +III enthalten das Metall in quadratisch-planarer
Koordination:
- Das Trichlorid AuCl3 enthält Dimere aus zwei [AuF4]-Quadraten (rote Quadrate).
- In der lustigen Struktur des Trifluorids AuF3
finden sich 61-Schraubenketten aus
über zwei Ecken verknüpften [AuF4]-Quadraten (rot: Au; grün: F).
(Darstellung mit AuF4-Quadraten
und Säulen, die die Schraubenachsen andeuten sollen, s. auch Abb. 9.1.XX).
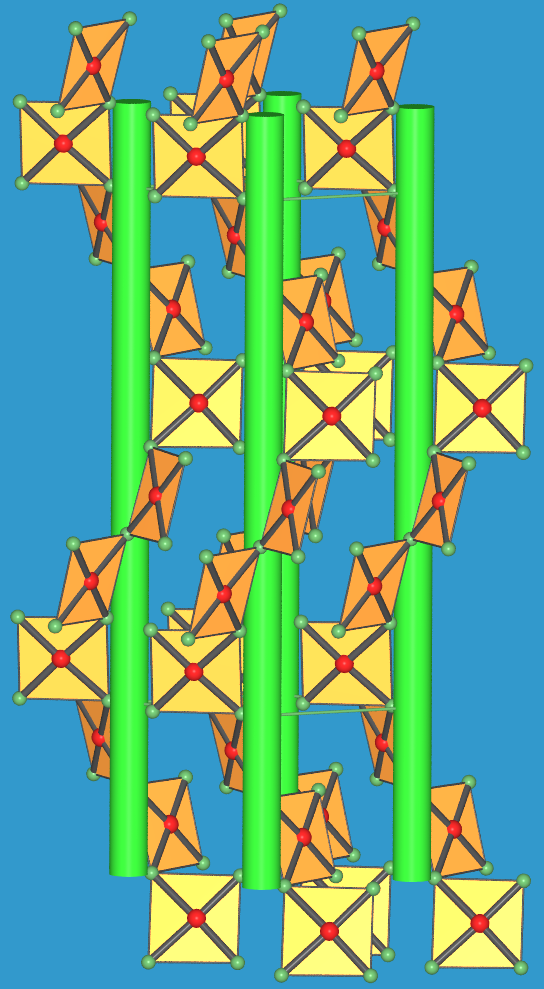 |
| 9.1.XX Kristallstruktur von AuF3 |
- Auch das Oxid Au2O3
enthält quadratisch-planar koordiniertes Gold (Quadrate entsprechen
einer [AuO4]-Einheit), die entsprechend der
Gesamtzusammensetzung recht kompliziert zu einem Raumnetz
verknüpft sind (Niggli-Formel: AuO3/3O1/2).
- ?? Au+II ?? Das Dichlorid
AuCl2, das
zuerst wie eine Gold(II)-Verbindung aussieht, besteht aus Molekülen
(Au: grün, Cl: rot),
ist also eine gemischtvalente Verbindung von Au(III) in quadratischer und Au(I)
in linearer Koordination.
- Au+I zeigt die bei d10-Systemen der schwereren
Übergangsmetalle typische lineare Koordination.
- AuCl (wie auch AuBr und AuI)
enthalten entsprechend Ketten aus Au(I)- (linear koordiniert, gelb) und
Halogenid-Ionen (X-, rot) (vgl. z.b. den Aufbau von
HgNH2+ beim Hg-Nachweis oder der Hg(II)-Chalkogenide,
z.B. Zinnober).
- Gold(I)-Komplexe sind ebenfalls immer linear aufgebaute
Verbindungen mit nur zwei Liganden.
- Gold zeigt sog. 'Auriphilie', die auf relativistische Effekte zurückzuführende Vorliebe
zur Ausbildung von Au-Au-Bindungen. Hierzu eine Sammlung
verschiedener Beispiele
(für alle Abbildungen: Au: rot; P: grün; C: schwarz; Halogene X: gelb)
Diese Reihe zeigt den Übergang zwischen Komplexen mit Metall-Metall-Bindungen
bis hin zu immer elektronenärmeren Systemen und letztlich Ausschnitte aus
Metall-Strukturen (CN=12, Ikosaeder bzw. Kuboktaeder).
Der Au55-Cluster verdeutlich auch sofort, wie die Strukturen
der Nanopartikel aussehen werden, die für die Lichtstreuung in 'Gold-Sol'
verantwortlich sind.
- Elementares Gold (Au0, Abb. 9.1.XXX) kristallisiert im
Kupfer-Typ (f.c.c.).
- Gold hat eine recht hohe Elektronegativität (je nach Skala bis 2.4) und ist in vielen Legierungen
deutich der negative Bindungspartner ('Auride'). Echte Aurid-Ionen Au-I
sind mit den schweren Alkalimetallen in
RbAu und CsAu beschrieben
(CsCl-Strukturtyp).
Es gibt auch Aurid-Oxide wie Cs3AuO, die
dann im Antiperowskit-Typ kristallieren.




























