Vorlesung Chemie der Metalle
9. Übergangsmetalle II
VII. Nebengruppe/7. Gruppe/Mangan-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel:
- Allgemeines
- Mangan
- Vorkommen
- Metall: Eigenschaften, Strukturen und Gewinnung
- Übersicht zu den Oxidationsstufen
- Chemie von Mn(II) (d5)
- Chemie von Mn(III)
- Chemie von Mn(IV) (d3)
- Chemie von Mn(V)
- Chemie von Mn(VI) und Mn(VII) (d0)
- Technetium
- Rhenium
Allgemeines
Die Elektronenkonfigurationen der drei Elemente sind
- Mn: 3d5 4s2
- Tc: 4d6 5s1
- Re: 5d5 6s2
Mangan kommt in allen Oxidationsstufen zwischen +II und +VII
vor. Die wichtigsten und in Mineralien auch häufigsten sind
dabei Mn(II) (d5) und Mn(IV) (d3, in oktaedrischer Koordination stabilisiert).
Dagegen dominiert bei Technetium (Tc*)
und Rhenium (Rh), entsprechen der Zunahme der Beständigkeit der höheren Oxidationsstufe
nach unten im Periodensystem, die Oxidationsstufe +VII die Chemie.
Mangan ist verhältnismäßig häufig, Tc ist ein radioaktives Element
und Rhenium ist relativ selten und wurde erst 1925 entdeckt.
Mangan
Vorkommen
Mangan ist (nach Eisen) mit einer Häufigkeit von 0.1 % in der
Erdkruste das zweithäufigste Übergangsmetall.
Die wichtigsten Manganminerale sind die Oxide
Hausmannit (Mn3O4, Abb. 9.7.1.), Braunit (Mn2O3)
und Pyrolusit (MnO2, 'Braunstein', Abb. 9.7.2.).
 |
 |
| 9.7.1. Hausmannit, Mn3O4
(Oktaeder, Spinell-Struktur) |
9.7.2. Pyrolusit, MnO2 (Gremmelsbach, Triberg, Schwarzwald) |
Mangan-Vesuvian (s. Abb. 7.X.) ist ein gemischtes Ortho/Disilicat, das
Mn2+ und Mn3+ auf den Kationenplätzen enthält
(Grundformel: Ca10(Mg,Fe)2Al4[Si2O7]2[SiO4]5(OH)4).
'Mangan-Knollen' (s. Abb. 9.7.3.) sind in grossen Tiefen (5000 m) im Meer zu finden
und enthalten bis zu 30 % Mangan in Form verschiedener Mn(II/III/IV) Oxide/Hydroxide
oder wasserhaltiger anderer Minerale (z.B. Buserit oder Birnessit). Diese Knollen wachsen
sehr langsam, werden aber aktuell auch als Rohstoffe diskutiert.
 |
| 9.7.3. Mangan-Knolle
(USA, 1000 Meilen südöstlich von Hawaii, aus 5000 m Tiefe)
|
Weitere Mangan-Minerale sind Manganit (MnO(OH)) und Rhodochrosit ('Manganspat', MnCO3).
Metall
Die Herstellung von elementarem metallischen Mangan kann z.B. durch
aluminothermische Reaktion von Hausmannit gemäß
3 Mn3O4 + 6 Al ⟶ 9 Mn + 4 Al2O3
durchgeführt werden.
Ferromangan, einer Mn-reiche (ca. 70 %) Eisen-Legierung, läßt sich technisch auch durch Reduktion mit
Kohlenstoff direkt im Hochofen darstellen.
Elementares Mangan ist eines der wenigen metallischen Elemente, das eine ganz eigene
ungewöhnliche und sehr komplexe Kristallchemie zeigt. Zwei der drei Modifikationen
haben ziemlich komplizierte kubische Strukturen, die hier
im Detail beschrieben sind.
 |
| Abb. 9.7.4. elementares Mangan |
Mangan selber ist relativ unedel (Mn2+/Mn0: -1.18 V) und ist löslich in nichtoxidierenden Säuren:
Mn + 2 HCl ⟶ MnCl2 + H2
An Luft verbrennt elementares Mangan zu Mn3O4.
Mangan schmilzt bei 1247 oC und ist ein sehr wichtiger Legierungspartner
in Stählen.
Übersicht Oxidationsstufen
Vier Oxidationsstufen von Mangan kann man bei der stufenweisen Reduktion
von Permanganat (Manganat(VII) mit Perborat sehen:
| ⚗ Reduktion von Permanganat
(225MB|MP4|H264) |
|
|
Mit Perborat (NaBO2 . H2O2 . 3 H2O)
kann Permanganat stufenweise reduziert werden:
MnVIIO4- (violett) ⟶
MnVIO42- (grün) ⟶
MnVO43- (blau) ⟶
MnIVO2 (braun)
|
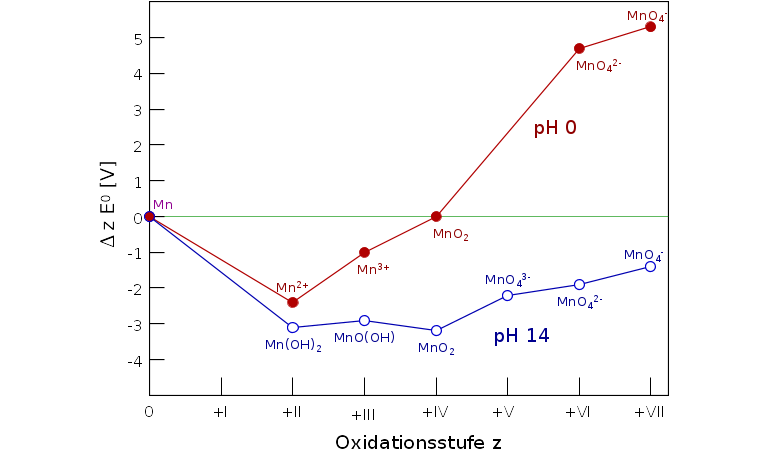
Die thermodynamische Stabilität der verschiedenen Oxidationsstufen, die wie die
jeweils vorliegenden Spezies selber stark
vom pH-Wert der Lösung abhängt, ist im Frost-Diagramm in Abb. 9.7.5. (links) zu entnehmen.
Im Pourbaix-Diagramm (s. Abb. 9.7.5. rechts, für c=1 mol/l) sind ebenfalls die bei den jeweiligen Potentialen
und pH-Werten stabilen Spezies dargestellt. (!Achtung: diese Diagramme sind abhängig
von den Konzentrationen der Lösungen und basieren auf thermodynamischen Daten!)
 |
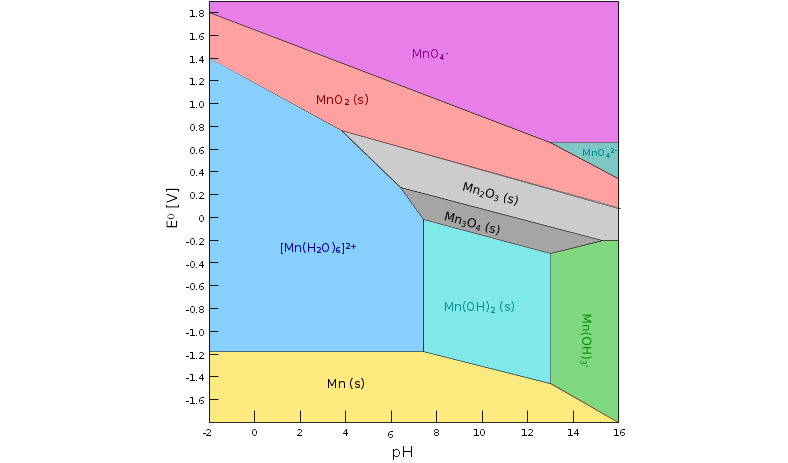 |
| 9.7.5. 'Frost'-Diagramm von Mn bei pH 0 (rot) und pH 14 (blau) (links)
‣SVG
sowie 'Pourbaix'-Diagramm (rechts)
‣SVG
|
Aus den beiden Diagramm wird deutlich, dass Mn in niedrigen Oxidationsstufen
unter basischen Bedingungen in Form der schwerlöslichen Oxide/Hydroxide vorliegt.
Nur bei extremen pH-Werten erfolgt Auflösung von Mn(II) in Form eines
Hydroxido-Komplexes (grünes Feld im Pourbaix-Diagramm).
Verbindungen mit Mangan in höheren Oxidationsstufen wirken im Sauren stark
oxidierend. Bei basischen Bedingungen (s. Versuch oben) sind alle
Oxidationsstufen von Mn(VII) bis Mn(IV) erhältlich, während das hellblaue
Manganat(V) in sauren Lösungen unbekannt ist. Im sauren Mileu ist vor allem
Mn(II) (in Form des Hexaquakomplexes) sehr stabil, während unter basischen
Bedingungen Mn(IV) in Form von Braunstein die stabilste Spezies, und damit zumeist
Endprodukt von Redoxreaktionen, ist
(vgl. Analytik, z.B. bei der Manganometrie).
Chemie von Mn(II)
Die Oxidationsstufe +II ist bei Mangan relativ stabil, da hier alle fünf d-Zustände
einfach besetzt sind (d5-Elektronenkonfiguration). Übergänge
zwischen den d-Niveaus sind damit Spin-verboten, so dass d-d-Übergänge kein Rolle
für die Farben der Salze und Komplexe spielen und viele Mn(II)-Verbindungen
maximal nur sehr blasse Farbe (meist leicht rosa) zeigen.
- Aus Mn(II)-haltigen Lösungen fällt bei Zugabe von Ammoniak (vgl. Analytik!)
das Hydroxid aus:
MnSO4 + 6 NH3 ⟶ Mn(OH)2 + Na2SO4
das in Laugen unlöslich ist.
- Das Anhydrid hierzu ist das Monoxid MnO, das NaCl-Struktur besitzt.
- Mangan(II) bildet mit NH3 einen Hexammin-Komplex:
Mn2+ + 6 NH3 ⟶ [Mn(NH3)6]2+
- Mit H2O2 entstehen unter Oxidation zu Mn(IV) braunschwarze Niederschläge des
Oxid-Hydroxids:
MnII(OH)2 + H2O2 ⟶ MnIVO(OH)2
- Weitere schwerlösliche Verbindungen von Mn(II) sind das Carbonat und das schwach rosa (vgl. Analytik)
gefärbte Sulfid:
Mn2+ + CO32- ⟶ MnCO3
Mn2+ + S2- ⟶ MnS
Das ist der Farbe nach NIE im Leben das Sulfid!!!
Chemie von Mn(III)
Mn(III) ist nur in festen Verbindungen bekannt, in Lösung erfolgt - unabhängig vom pH-Wert, s. Frost-Diagramm
in Abb. 9.7.5. links - Disproportionierung zu MnII und MnIV.
- Bekannte Sauerstoffverbindungen und Minerale mit Mangan in der Oxidationsstufe +III sind
der Braunit, Mn2O3,
und der gemischtvalente Hausmannit (Mn3O4, s. Abb. 9.7.1).
- Der Hausmannit kristallisiert in der Spinell-Struktur und
enthält ein MnII- und zwei MnIII-Ionen
pro Formeleinheit. Es handelt sich um einen Normalspinell, die Oktaeder um MnIII
sind Jahn-Teller verzerrt.
- α-Mn2O3 kristallisiert in der C-Typ-Struktur
(auch Bixbyit- oder Defekt-Anti-CaF2-Typ).
Hier bilden die Mn2+-Kationen eine kubisch dichteste Kugelpackung und
die Oxid-Ionen besetzen 3/4 der Tetraederlücken
(kubisch, Raumgruppe Ia3, mit magnetischer Ordnung pseudo-kubisch Pbca).
- Die schwarze γ-Form von Mn2O3 ist isotyp zu γ-Al2O3
und γ-Fe2O3 (Defekt-Spinell) und entsteht wie diese
beim vorsichtigen Entwässern der Hydroxiden.
- Weitere Verbindungen sind MnO(OH) (Manganit) und Komplexe wie [MnF6]3-.
- Das Pigment 'Mangan-Violett' ist ein Ammonium-Mn(III)-Pyrophosphat NH4Mn[P2O7]
(s. Abb. 9.7.6.). Es wird in der Kosmetik und der Malerei verwendet.
 |
| 9.7.6. Mn-Violett: NH4Mn[P2O7] |
Chemie von Mn(IV)
Mn(IV) kommt als MnO2 im Pyrolusit (s. Abb. 9.7.2.) vor.
"Braunsteine" sind Mischungen verschiedener auch Wasser- und/oder Kationen-haltige Niederschläge.
Es handelt sich genaugenommen um eine nichtstöchiometrische
Verbindung, die besser als MnO2-x
(Rutil-Struktur, bis x=0.05) zu formulieren ist.
MnO2 ist ebenfalls ein recht starkes Oxidationsmittel (vgl. Analytik, s. Frost-Diagramm in Abb. 9.7.5) und kann z.B.
aus HCl Chlor freisetzen:
MnO2 + 4 HCl ⟶ MnCl2 + Cl2
MnO2 ist amphoter. Mit Säuren bildet es (wie Metalle) hydratisierte Kationen
Mn4+, mit Laugen entstehen Manganate MnO44- bzw. MnO32-.
Chemie von Mn(V)
MnV existent als MnO43- nur im Alkalischen (s. Video und Frost-Diagramm).
Bei anderen pH-Werten erfolgt Disproportionierung. Das Ion ist hellblau.
Chemie des Mn(VI) und Mn(VII)
MnVI ist im alkalischen Medium stabil in Form des Manganat(VI)-Ions MnO42-,
unter sauren Bedingungen liegt dagegen MnVII in Form des bekannten Permanganat-Ions
MnO4- vor. Manganate(VI) entstehen (vgl. Analytik) in oxidierenden Schmelzreaktionen
(Oxidationsschmelze):
MnSO4 + 2 K2CO3 + 2 KNO3
⟶ K2MnO4 + 2 KNO2
Das Manganat(VI)-Ion ist in Lösung grün. Beim Ansäuern geht es unter Dispropotionierung
in MnVII und MnII über (s. Frost-Diagramm):
5 MnVIO42- + 8 H+ ⟶ 4 MnVIIO4-
+ Mn2+ + 4 H2O
Eingebaut in die Baryt-Struktur ist das Ion MnVIO42- haltbar
und es entsteht ein Pigment, das 'Mn-Blau' genannt wird (s. Abb. 9.7.7.).
 |
| 9.7.7. Mn-Blau: BaSO4:MnVI |
Durch Peroxoschwefelsäure (mit Ag+ als Katalysator),
Salpetersäure oder PbO2 läßt sich Mn2+ in saurer Lösung
zum Permanganat oxidieren, z.B.
2 Mn2+ + 5 H2S2O8 + 8 H2O ⟶
2 MnO4- (violett) + 10 H2SO4 + 6 H+
Auch Braunstein, MnO2 kann mit starken Oxidationsmitteln
wie Cl2, O3 oder auch elektrolytisch zum Permanganat oxidiert werden.
Das Permanganat-Ion ist selbst ein starkes Oxidationsmittel, das bei
alkalischen Bedingungen zu Braunstein MnO2, bei sauren Bedingungen zum
Mn2+ reduziert wird. So läßt sich z.B. schweflige Säure zu Schwefelsäure und
Iodid zu Iod oxidieren.
Synproportionierungsreaktionen von Mn(VII) und Mn(II) führen zu Mn(IV):
2 MnVIIO4- + 3 Mn2+ + 4 OH- + 3 H2O
⟶ 5 MnIVO(OH)2 (braunschwarz)
Das Anhydrid der zugehörige Säure HMnO4 ist Mn2O7,
ist ebenfalls stark oxidierend und ein flüchtiges Öl, das unter Explosion zerfällt.
2 Mn2O7 ⟶ 4 MnO2 + 3 O2
Diese Reaktion sieht man beim Versuch 'Sturm im Wasserglas' (auch 'Mn-Blitze') aus:
2 KMnO4 + H2SO4 ⟶ K2SO4 + Mn2O7 + H2O
| ⚗ Mn-Blitze
(19MB|MP4|H264) |
|
|
Kleine Kristall von Kaliumpermanganat werden auf die Grenzfläche zwischen
konz. Schwefelsäre (unten) und absolutem Ethanol (oben) gestreut.
Das entstehende grüne Öl ist Mn2O7, das Anhydrid der
Permangan-Säure, das unter explosionsartige Zersetzung reagiert.
|
Technetium
Radioelement (künstliches Element, entsteht bei der Kernspaltung). Chemisch dem
Rhenium sehr ähnlich.
Rhenium
Rhenium kommt gemeinsam mit Molybdän im Molybdänit MoS2 vor.
Die Darstellung erfolgt durch die Reduktion der Oxide oder Sulfide mit Wasserstoff
oder elektrolytisch. Es kristallisiert in einer hexagonal-dichten Kugelpackung
und wird in Legierungen für Thermoelemente und Glühdrähte (wegen des hohen Schmelzpunkts)
verwendet. Die Oxidationsstufe +7 ist ziemlich stabil.
Re2O7 ist aus oxidierendem Medium destillierbar, also weitgend kovalent aufgebaut.
Das Oxid ReO3, der Namensgeber eines sehr einfachen und grundlegenden
Strukturtyps, ist rot.
Oxide, Sulfide und Halogenide sind auch von den Oxidationsstufen IV, V, und VI gut charakterisiert,
aber unbeständiger als die o.g. Oxide.
ReCl3 enthält Cluster mit einem Re3-Dreieck,
[Re2Cl8]2- die berühmte Re-Re-Vierfachbindung.
Typische Reaktionen mit Perrhenaten, [ReO4]- sind:
2 ReO4- + 7 H2S + 2 H+
⟶ Re2S7 (schwarz) + 8 H2O
ReO4- + [(C6H5)4As]+
⟶ [(C6H5)4As]ReO4
Perrhenate zeigen die charakteristischen Reaktionen aller [XO4]--Ionen.









