Vorlesung Chemie der Metalle
9. Übergangsmetalle II
VI. Nebengruppe/6. Gruppe/Chrom-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel:
- Allgemeines
- Chrom
- Vorkommen und Gewinnung
- Metallisches Chrom
- Chemie von Cr(III)
- Chemie von Cr(VI)
- Weitere seltene Oxidationsstufen von Chrom
- Komplexchemie von Chrom
- Molybdän
- Vorkommen, Metall
- Mo in wässriger Lösung
- Halogenide
- Chalkogenide
- Mo in der Biosphähre
- niedrige Oxidationsstufen
- Iso- und Heteropolysäuren
- Wolfram
- Vorkommen und Gewinnung
- Eigenschaften und Vewendung des Metalls
- Halogenide
- Oxide und Oxido-Anionen
- Sonstige Verbindungen
Allgemeines
Die Elemente der VI. Nebengruppe (neue Nomenklatur: 6. Gruppe), Chrom,
Molybdän und Wolfram,
haben die folgenden Gesamt-Elektronenkonfigurationen:
- Cr: 3d5 4s1 (3d4 4s2)
- Mo: 4d5 5s1 (4d4 5s2)
- W: 5d4 6s2
Wie bei allen Übergangsmetallen nimmt die Beständigkeit der höchsten Oxidationsstufe
der Gruppe im Periodensystem nach unten zu.
Die wichtigsten Oxidationsstufen sind damit im Einzelnen (fett: die wichtigste Oxidationssstufe):
- Cr: 0, I, II, III, IV, V, VI (starkes Oxidationsmittel)
- Mo: 0, I, II, III, IV, V, VI
- W: 0, I, II, IV, V, VI
Die Oxidationsstufe II (und kleiner) ist bei allen Elementen nur im Festkörper oder in
Komplexen mit π-Akzeptor-Liganden stabil, in Lösung
sind die entsprechenden Spezies starke Reduktionsmittel.
Für Molybdän und Wolfram wird die Chemie von der Oxidationsstufe VI dominiert.
Die reinen Metalle haben als Elemente in der Mitte
der d-Elemente sämtlich kleine Metallradien, hohe Schmelzpunkte
und eine hohe Korrosionsbeständigkeit. Molybdän und Wolfram sind
wegen der Lanthanoidenkontraktion noch recht ähnlich. Die wässrige
Chemie des Chroms ist aus der Analytik relativ gut bekannt (hoffentlich!).
Chrom
Vorkommen und Gewinnung
Das wichtigste Chrom-Mineral ist der Chromeisenstein, FeCr2O4
(Spinell-Struktur).
Die Darstellung des Elementes aus diesem Mineral durch Reduktion mit Kohlenstoff ist wegen
der Carbidbildung nicht möglich. Statt dessen werden angewendet:
- Die elektrolytische Reduktion. (vgl. auch 'Verchromung' als Veredelung von Metalloberflächen)
- Für sehr reines Chrom die aluminothermische Reduktion (Thermitverfahren):
Cr2O3 + 2 Al ⟶ Al2O3 + 2 Cr
- Für die Herstellung von Ferrochrom (einer Fe-Legierung mit bis zu 60 % Chrom)
ist die Reduktion von Chromit mit Kohle jedoch einsetzbar:
FeCr2O4 + 4 C ⟶ Fe + 2 Cr + 4 CO
Metallisches Chrom
Chrom ist dimorph, α-Cr kristallisiert kubisch innenzentriert, ß-Cr bildet eine
hexagonal dichte Kugelpackung.
Die Dichte beträgt 6.9 g/cm3, der Schmelzpunkt ist mit 1903 oC
deutlich höher als z.B. der von Eisen.
 |
| 9.6.1. Chrom |
Chrom ist in feuchter Luft beständig. Die elektrolytische Verchromung
wird ausgehend von Chromat(VI) durchgeführt:
CrO42- + 8 H+ + 6 e- ⟶ Cr + 4 H2O
Elementares Chrom reagiert mit Säuren unterschiedlich:
- mit verdünnter H2SO4 und verdünnter
HCl entsteht H2 und Cr2+.
- In verd.
nicht löslich.
- Auch in konzentrieter HNO3 kommt es zur Bildung einer
Oxidschutzschicht.
Diese Passivierungsschicht wird beim anodischen Oxidieren (Eloxal-Verfahren)
verstärkt.
Passiviertes Chrom ist dann nicht mehr in verdünnten Säuren
löslich.
Die Passivierung kann durch Schalten als Kathode aufgehoben werden, dann
ist es wieder löslich.
Das Potential beträgt im passivierten Zustand: +1.3 V und liegt
damit in der Spannungsreihe zwischen dem von Hg und Au.
Chemie von Cr(III)
Das wasserfreie Trichlorid CrCl3 kann aus den Elementen erhalten
werden:
2 Cr + 3 Cl2 ⟶ 2 CrCl3
Es ist Namensgeber eines Strukturtyps, in dem z.B. auch Aluminiumtrichlorid
kristallisiert. Die wasserfreie Form besteht aus violetten Kristallen,
die ähnlich wie AlCl3 sublimiert werden können.
Sehr reines CrCl3 löst sich unendlich langsam in
H2O, bei Zusatz von wenig CrII geht die Auflösung
jedoch sehr rasch.
CrCl3(H2O)3 + 4 H2O ⟶
[CrCl2(H2O)4]Cl ⟶ +H2O/-H2O
⟶ [Cr(H2O)6]Cl3 (dunkelgrün violett)
Beim Erhitzen ist die Reaktion rückläufig und es entsteht das
hellgrüne [CrCl(H2O)5]Cl2.
Eine weitere bekannte Cr(III)-Verbindung ist der violette Chromalaun,
KCr(SO4)2 . 12 H2O
(zur Struktur), der in der Ledergerbung verwendet wird.
CrCl3 reagiert mit Laugen zu Cr(OH)3, das wie das entsprechende Al-Salz amphoter ist:
- CrCl3 + 3 OH- ⟶ Cr(OH)3 + 3 Cl-
- Cr(OH)3 + 3 HCl ⟶ CrCl3 + 3 H2O
- Cr(OH)3 + 3 NaOH ⟶ Na3[Cr(OH)6] (Natriumhexahydroxidochromat(III)
2 Cr(OH)3 ⟶ T ⟶ Cr2O3+ 3 H2O (Cr2O3 grüne Malerfarbe)
Cr2O3 + 2 NaOH ⟶ Schmelze ⟶ 2 NaCrO2 (Chromit) + H2O
Chromtrioxid Cr2O3 (Abb. 9.6.2.) kristallisiert in der
Korundstruktur und findet als Grünpigment Verwendung (z. B. bei Kunstrasen).
Geringe Anteile von Cr2O3 in Al2O3
sind für die rote Farbe von Rubin verantwortlich. Im Unterschied zu
den kanzerogenen Chromaten(VI) sind diese Cr(III)-Oxide untoxisch.
 |
| 9.6.2. Cr2O3 |
Chemie von Cr(VI)
Chrom im sechswertigen Zustand ist nur in Oxoverbindungen bekannt.
Die Darstellung erfolgt durch Oxidation Cr(III) ⟶ Cr(VI) z.B. mit
O2/Na2CO3.
Im alkalischen Medium z.B. nach:
2 Cr3+ + 10 OH- + 3 H2O2 ⟶
2 CrO42- + 8 H2O
oder bei der Oxidationsschmelze nach:
Cr2O3 + 3 NaNO3 + 2 Na2CO3
⟶ Schmelze ⟶ 2 Na2CrO4 + 3 NaNO2 + 2 CO2
Ebenso wird auch in der Technik verfahren, wobei jedoch O2 als Oxidationsmittel
anstelle von NaNO3 verwendet wird.
Im sauren Medium läßt sich die Oxidation mit Peroxidodisulfat durchführen:
2 Cr3+ + 3 S2O82- + 8 H2O ⟶ 2 CrO42-
+ 6 H2SO4 + 4 H+
Cr(VI) wirkt oxidierend (Chromschwefelsäure früher als brutales Reingungsmittel):
2 K2CrO4 + 16 HCl ⟶ 4 KCl + 2 CrCl3 + 3 Cl2 + 8 H2O
und ist hochkanzerogen.
Die in wässriger Lösung vorliegenden Spezies werden durch das
pH-abhängige Chromat-Dichromat-Gleichgewicht (s. Versuch) bestimmt:
2 CrO42- (gelb) + 2 H+
⟶ Cr2O72- (orange) + H2O
| ⚗ Chromat-Dichromat-Gleichgewicht
(17MB|MP4|H264) |
|
Bei Zugabe von konzentrierten Säuren werden auch noch höher
kondensierte Polyanionen gebildet wie
Cr3O102- oder Cr4O232-
(Isopolysäuren), bzw. allgemein Polychromate
(CrnO3n+2)2-.
Die vollständige Kondensation führt zu polymerem (CrO3)x
(s. Abb. 9.6.3.; Struktur analog zum Asbest-artiges SO3, d.h. Ketten aus eckverknüpften Tetraedern).
CrO3 ist ein sehr starkes Oxidationsmittel.
 |
| 9.6.3. CrO3 |
Die folgenden schwerlöslichen Chromate können (z.B. aus acetat-gepufferten Lösungen) gefällt werden:
- BaCrO4 (gelb)
- PbCrO4 (gelb, auch als Pigment)
- Ag2CrO4 (rotbraun)
- Hg+I2 CrO4 (orangerot)
Bis auf die Hg-Verbindung sind alle in verdünnter HNO3
löslich.
Ein sehr interessanter Versuch zur Chemie des Chroms ist der
chemische Vulkan (s. Versuchsvideo):
(NH4)2Cr2O7
⟶ - H2O ⟶ 2 NH3 + 2 CrO3 ⟶ N2 +
Cr+III2O3 + 3 H2O
Cr2O3 entsteht dabei als luftiges grünes
Pulver (s. Pigment in Abb. 9.6.2). Bei dieser Reaktion wird also der Ammoniak oxidiert und
reduziert das Chrom.
| ⚗ Chromat-'Vulkan'
(22MB|MP4|H264) |
|
Chromylchlorid, CrO2Cl2, kann aus HCl und H2CrO4 bzw.
NaCl, K2CrO4 und H2SO4
als dunkelrote, destillierbare Flüssigkeit mit einem Siedepunkt
von 116.7 oC erhalten werden.
Peroxidoverbindungen enthalten Cr(VI) mit Peroxid-Ionen als Liganden:
- Blaue Peroxidodichromate MI2[Cr2O12]
erhält man aus sauren Chromatlösungen gemäß:
Cr2O72- + 5 H2O2 ⟶
Cr2O122- + 5 H2O
- Die roten Peroxidomonochromate M3I[CrO8]
können aus alkalischer
Chromatlösung und 30 %-iger H2O2 erhalten werden:
2 CrO42- + 7 H2O2 + OH- ⟶
2 CrVO8- + 8 H2O
Vier Peroxido-Liganden sind jeweils μ2 gebunden.
- Bekannt ist auch der sogenannte Chrom'schmetterling', das in Ether lösliche neutrale
Chrom(VI)-Oxid/Peroxid Cr(O)(O2)2.
Weitere seltene Oxidationsstufen von Chrom
Chemie von Cr(V)
Cr(V) ist selten, bekannte Verbindungen mit dieser Oxidationsstufe sind z.B. CrF5 oder
Na3CrO4 usw. In wässrigen Lösungen ist
Chromat(V) jedoch unbekannt, da es sofort disproportioniert.
Chemie von Cr(IV)
Bekannte Verbindungen von Cr in der Oxidationsstufe IV sind
CrF4, CrCl4, CrBr4 und CrO2.
Cr4+ ist wie Cr5+ in wässriger Lösung
unbeständig. Chromdioxid wurden früher in Tonbändern als Magnetpigment verwendet
('Kasettenrekorder').
Chemie von Cr(II)
Cr(II) kann durch Reduktion von Cr(III) erhalten werden:
2 Cr3+ (grün) + Zn ⟶ 2 Cr2+ (blau) + Zn2+
In Wasser liegt es als Hexaquokomplex vor.
Das schwarze Monoxid CrO kristallisiert in der NaCl-Struktur.
Cr(II) ist ein starkes Reduktionsmittel und wird an der Luft zu Cr(III)
oxidiert. Auch Cr3O4 (Chromspinell = ein Normalspinell
mit Cr3+ in Oktaederkoordination) enthält Cr(II).
Komplexchemie von Cr
Am stabilsten sind Cr(III)-Komplexe.
Aquo- und Sulfatokomplexe des Cr(III) sind z.B. KCr(SO4)2 . 12 H2O.
Beim Erhitzen entsteht aus dem vorliegenden violetten Komplex
[Cr(H2O)6]3+ der
grüne Sulfatokomplex [Cr(H2O)4(SO4)]+.
Aus einer Lösung von [Cr(CH3COO)6]3-
erfolgt mit NH3 keine Fällung von Cr(OH)3.
Cr3+-Komplexe sind wegen der d3-Konfiguration
sehr stabil und entsprechend substitutionsinert, reagieren also immer sehr langsam.
Die abertausenden von Komplexen des CrIII liegen als oktaedrische
Komplexe vor. Ammin-Komplexe (am=NH3; en = 1/2 H2N-CH2-CH2-NH2
R= Säurerest (z.B. Cl-, SO42-)
sind ganze Reihen bekannt:
- [Cr(am)6]3+: reine Amine
- [Cr(am)6-n(H2O)n]3+: Amin-aquo-Komplexe
- [Cr(am)6-nRn](3-n)+ Amin-acido-Komplexe
- [Cr(am)6-n-m(H2O)nRm](3??)+ Amin-acido-Komplexe
- Acidokomplexe: [CrX6]3-, X= Cl-, F-, Br-, NCS-, CN- u.a.
Komplexe von Cr(II) (oktaedrisch, HS-d4) sind
z.B. [Cr(NH3)6]2+ oder [Cr(SCN)6]4-.
Cr0 hat d6-Elektronenkonfiguration und bildet daher mit sechs
Liganden bzw. sechs Elektronenpaaren 18-Elektronenkomplexe:
- Cr(CO)6
- Cr(α,α'-dipyridyl)3
- Cr(C6H6) Dibenzolchrom
- K6Cr(CN)6
Molybdän
Vorkommen, Metall
Molybdänglanz (auch Molybdänit, Abb. 9.6.4.), MoS2, ('Moly')
kommt in Colorada (USA), aber auch im Erzgebirge, vor.
Weiteres Mo-Mineral ist das Gelbbleierz (Wulfenit, PbMoO4).
Der Name kommt von molybdos (gr. für Blei), da es wie Blei
abfärbende Minerale bildet.
Zur Darstellung von reinem Molybdän wird zunächst das Sulfid bei 400 bis 600 oC
geröstet:
MoS2 ⟶ MoO3
und anschließend mit Wasserstoff bei 1100oC reduziert.
Ferro-Molybdän wird durch gemeinsame Reduktion von MoO3
und Fe-Erz mit Kohle oder Al erhalten.
60 % fallen als Nebenprodukt bei der Cu-Herstellung an, und zwar
bei der Abtrennung der Erze durch Flotation (Cu: 4 %, Mo: 0.04 %)
Wolfram wird wegen des hohem Schmelzpunktes als Beiprodukt gefürchtet.
 |
 |
| Abb. 9.6.4. Molybdänit, MoS2 |
Abb. 9.6.5. Elementares Molybdän |
| (Moly Hill Mine, La Motte, Quebec, Kanada) |
|
Molybdän kristallisiert (wie Wolfram) in der kubisch innenzentrierten (b.c.c.)
Struktur. Es hat sieben verschiedene Isotope. Geochemisch ist Molybdän daher
zur Datierung wichtig.
Das Metall ist weißglänzend, hart, dehnbar und von großer mechanische Festigkeit
Der Schmelzpunkt liegt bei 2620 oC (!). Die Elektronegativität ist 1.6.
Das Normalpotential (bei Oxidation nach +2) beträgt E0 = -0.2 V.
Verwendung findet Molybdän in geringen Mengen im Stahl: Es erhöht die Zähigkeit und
die Härte von Stahl (z.B. wichtig im Kesselbau).
Reines Molybdän wird als Elektroden und als Katalysator in der Petrochemie
eingesetzt.
Die möglichen sehr niedrigen Oxidationsstufen
liegen zwischen -II und +II. Molybdän(-II) findet
sich im Carbonylat [Mo(CO)6]2-, Mo(0)
in dem einfachen elektronenpräzigen Carbonylkomplex [Mo(CO)6].
Auch +II und +III sind noch recht niedrige Oxidationsstufen, von denen es
(jeweils im Unterschied zum Chrom) keine ausgedehnte Komplexchemie gibt.
Alles folgende für die Oxidationsstufen +IV bis +VI, wo es vor allem
eine umfangreiche Clusterchemie und interessante Mehrfachbindungen gibt.
Mo in wässriger Lösung
Molybdän kann in wässriger Lösung in allen
Oxidationsstufen zwischen +III und +VI vorliegen. Dies wird
im folgenden Versuch gezeigt:
| ⚗ Redoxreaktionen von Molybdän
(95MB|MP4|H264) |
|
|
In saurer Lösung wird MoO42-, das bei
niedrigen pH-Werten zu verschiedenen Isopolymolybdaten reagiert,
mit Zink bis zu Mo(III) reduziert. In hochkonzentrierten Lösungen
liegt Mo(III) als grassgrünes diamagnetisches Oktaeder-Dimer
[Mo2(OH)2(H2O)8]4+ vor.
Beim Verdünnen entsteht der hellgelb-braune Aquakomplex
[Mo(H2O)6]3+.
Bei Zugabe von festem Natriummolybdat(VI) kommt es zur Synproportionierung
zwischen Mo(III) und Mo(VI) und es bildet sich das
grüne Ion [MoO(H2O)5]3+ (oder [MoOCl5]2-),
das mit weiterem Mo(VI) letztlich
gemischtvalentes blaues Mo(V/VI) (sog. Molybdän-Blau) ergibt.
|
VI: CrO42-, das Dichromat und das Anhydrid CrO3 (Tetraederketten)
alles in CN=4, sind sämtlich starke Oxidationsmittel.
Auch bei den Molybdaten gibt es eine noch viel komplexere
Kondensationschemie (ohne Redoxchemie) beim Ansäuern:
Molybdatlösung + HNO3 ⟶ Molybdänsäure
⟶ Molybdylverbindungen
Na2MoO4 + 2 HNO3 ⟶ ⟶ MoO3.x H2O
⟶ ⟶ MoO2(H2O)2]2+
Kondensation bis zum Anhydrid: (Säuren: Isopolysäuren)
- MoO42- (isolierte Tetraeder)
- Mo7O246-
- Mo8O264-
- [Mo36O112(H2O)16]8-
- etliche andere synthetisch bei speziellen Kationen/Bedingungen:
- [Mo6O19]2-
- Anhydrid: MoO3 x H2O (x=1,2)
x=1 (Monohydrat) dimorph:
./Xfig_bilder/scherung_mo_o.ps
pH unter 0: wieder Auflösung:
MoO3 ⟶ [MoO2(H2O)2]2+ (Molybdänyl-Ion)
(beide O benachbart)
Wichtige Verbindungen für die Analytik sind die schwerlöslichen Molybdate:
- Na2MoO4 + Pb2+ ⟶ MoO2(NO3)2 + H2O
- Hexycyanoferrat ⟶ (MoO2)2[Fe(CN)6] . H2O (braun)
- stöchimetrisch nicht genau definiert
- Heteropolysäuren: (NH4)3[P(Mo12O40)]
statt P auch Si, Ge, Sn, Al usw. usw. (70 verschiedene Elemente)
für diese extrem kleiner gravimetrischer Faktor
Wie auch bei Chrom sind zusätzlich Peroxido-Verbindungen bekannt, die mit H2O2
gebildet werden. (Mo(O2)42+ ist tetraedrisch bzw.
- wenn man die Sauerstoffatome einzeln betrachtet - dodekaedrischer aufgebaut.
Während beim Chrom vor allem +III und +VI und dazwischen in Lösung praktisch nichts
stabil ist, gibt es
Redox-Chemie:
Abrauchen mit H2SO4 ⟶ Molybdänblau (4,6, Mischoxide)
enthält O- und OH-Gruppen, z.B.
- MoO2.88.H2O mittlere Oxidationszahl 5.76
- MoO2.5(OH)0.5 mittl. Oxidationszahl 5.50
- MoO2.0(OH) mittl. Oxidationszahl 5.0
alle blau
nichtstöchiometrische Verbindungen (analog Wolframblau)
in Lösung komplexe Oxo-Anionen mit niedrigen OS und Mo-Mo-Bindungen
z.B.
Mo3+IVO4(H2O)9]+4
(in dem drei Oktaeder über Kanten kondensiert sind.
mo3o4+.ps
Halogenide
Bei den Halogeniden des Molybdäns sind für die einzelnen Oxidationsstufen
bekannt:
- +VI: Halogenide mit der Oxidationsstufe +VI sind nur von Fluor bekannt:
MoF6 ist eine farblose Flüssigkeit. Mit den anderen Halogenen X
erfolgt Zersetzung in MoX4 und X2
- +V:
- X = F: Mit Fluor entstehen Tetramere (MoF5)4, in
denen vier Oktaeder über Ecken verknüpft sind.
- X = Cl: Im Chlorid liegen Dimere Mo2Cl10 vor,
zwei Oktaeder sind über eine Kante verknüpft.
- IV: Die Tetrahalogenide MoX4 sind für X = F, Cl und Br bekannt.
- III: Die Trihalogenide MoX3 kennt man für alle Halogenide
X = F, Cl, Br, I. Sie kristallisieren in der
Schichtstruktur von CrCl3.
- II: Die Dihalogenide mit X = Cl, Br, I sind sehr interessant aufgebaut. Sie
bestehen aus oktaedrischen Clustern mit Mo-Mo-Bindungen. Über den Flächenmitten
dieser Mo6-Oktaeder befinden sich acht Chlorido-Liganden. An den sechs
Ecken sind weitere Chlor-Atome gebunden. Diese Cluster mit der Gesamtzusammensetzung
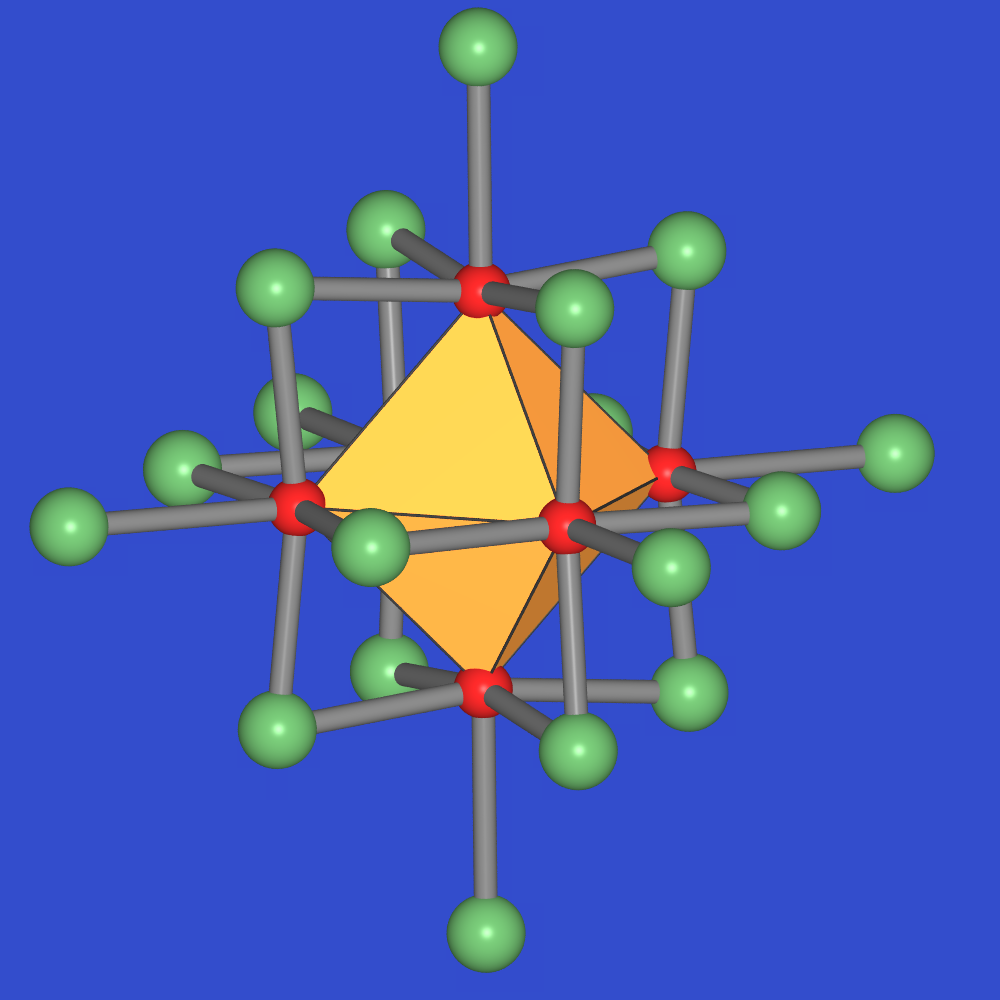
[Mo6X14] sind an vier Cl-Ecken zu Schichten verknüpft (Abb. 9.6.6.). Mit
der Niggli-Schreibweise folgt also [Mo6X10X4/2]
und damit Mo6X12 bzw. wieder MoX2.
 |
| Abb. 9.6.6. Kristallstruktur
von Mo6Cl12
‣VRML |
Chalkogenide
Oxide:
Die wichtigsten Molybdän-Oxide, wieder geordnet nach Oxidationsstufen sind:
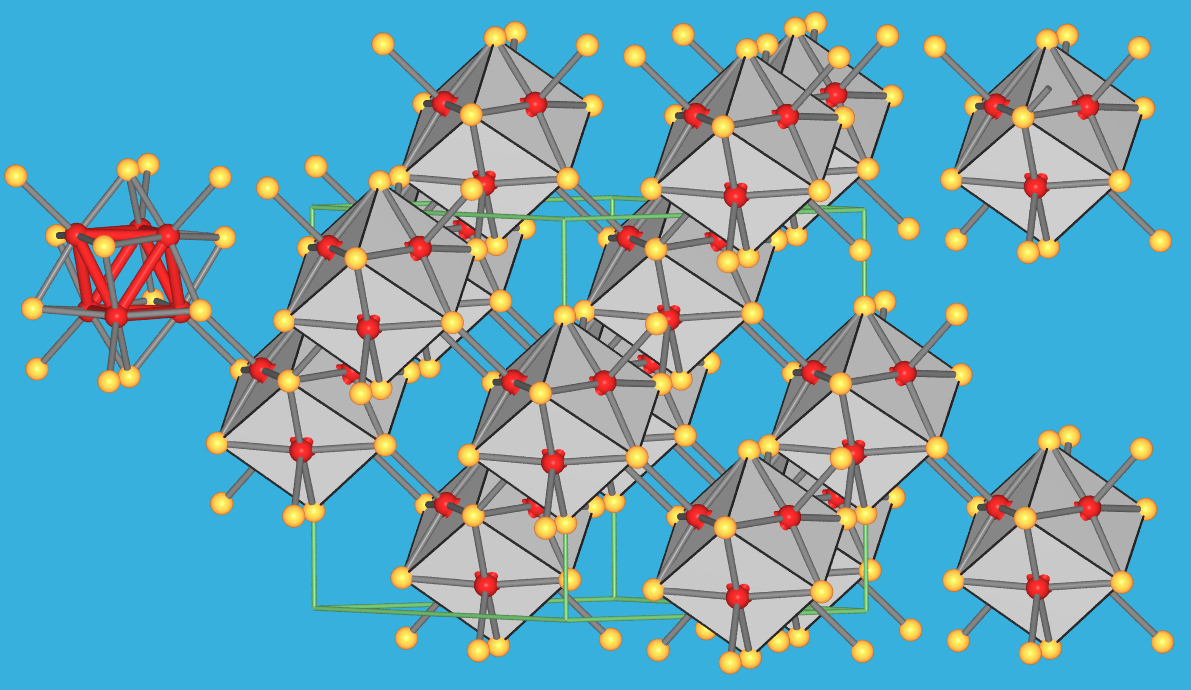
- +VI: MoO3 kristallisiert nicht im einfachen ReO3-Typ. Es handelt sich vielmehr
um eine sogenannte 'Scherstruktur' (s. Abb. 9.6.7), in der zwei Oktaederschichten des ReO3-Typs gegeneinander
geschert sind, so dass Kantenverknüpfung zwischen zwei Oktaederschichten auftritt und das
ReO3-Raumnetz zu Doppelschichten abgebaut ist (MoO3, VRML-2 der Scherung).
 |
| Abb. 9.6.7. Kristallstruktur
von MoO3
‣VRML |
- +V bis +VI: Mo9O26, Mo8O23,
Mo5O14, Mo17O47, Mo4O11
(alle blau, Scherstrukturen; Mo8O23 als Bild vorhanden
- +IV: MoO2 (violett, elektrische Leiter, diamagnetisch, verz. Rutil-Typ)
- Es gibt keine Oxide mit Oxidationsstufen kleiner als +IV.
Sulfide: Die beiden wichtigsten Sulfide sind:
- +VI: Thiomolybdate und MoS3
MoVIO42- + 4 H2S ⟶
MoS42- + 4 H2O
MoOS2- + 2 H+ ⟶ MoS3 (braun) + H2S
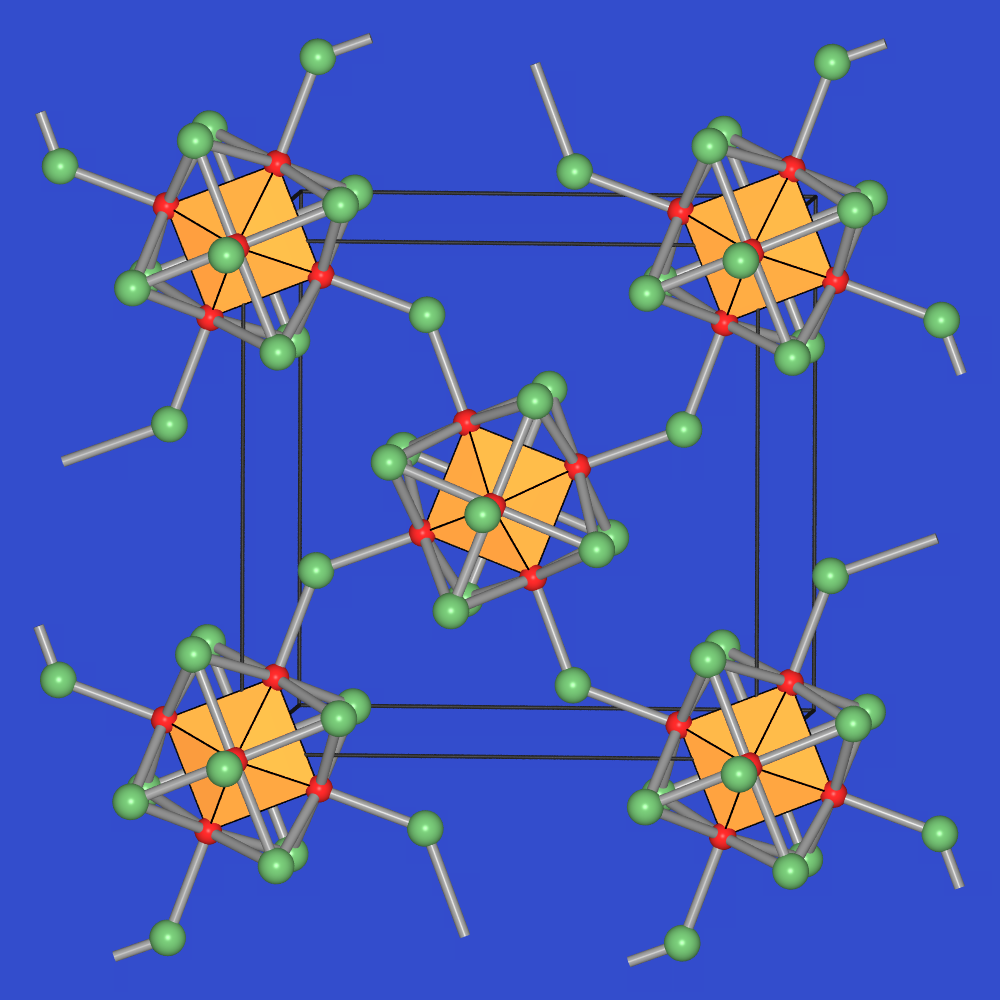
- +IV: MoS2 (Molybdänglanz), Blättchen, Schmiermittel ('Molykote')
hat eine eigene Struktur, die in Abb. 9.6.8. gezeigt ist:
 |
| Abb. 9.6.8. Kristallstruktur
von MoS2
‣VRML |
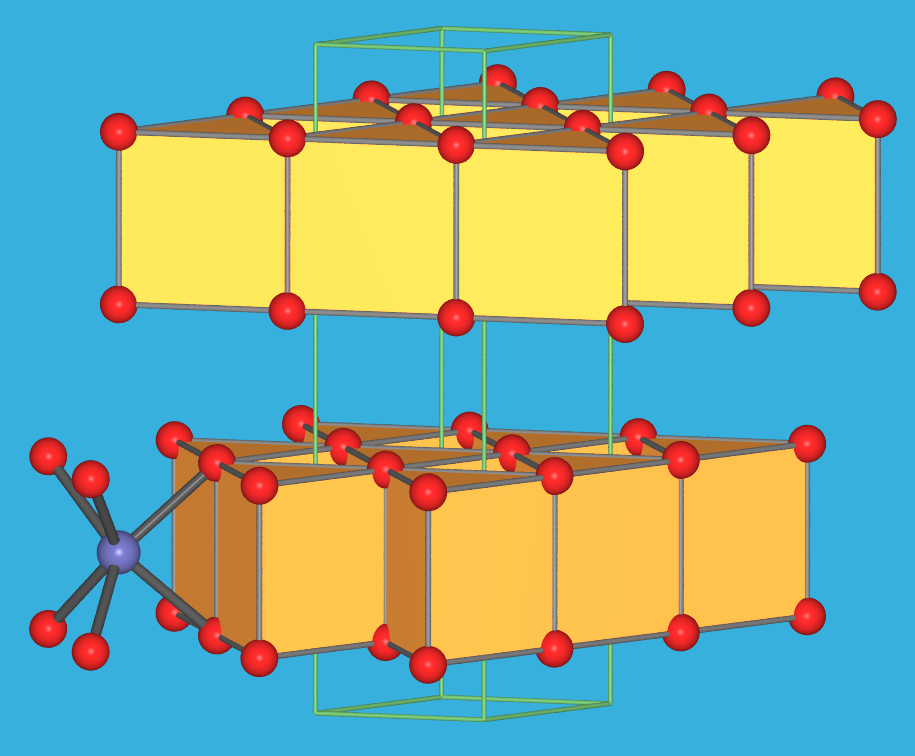
Chevrell-Phasen
Die Chevrell-Phasen sind Supraleiter 2. Art mit Sprungtemperaturen von 15 K.
Besonders ist jedoch nicht die - nicht so extrem hohe - Sprungtemperatur,
sondern die besonders hohe kritische Feldstärke von 540 kG = 54 Tesla.
Die allgemeine Formel der Chevrell-Phasen ist Mx[Mo6X8].
In der Struktur (s. Abb. 9.6.9) bilden die Mo-Atome einen oktaedrischen Metallcluster,
X steht für S, Se oder auch Te.
Die elektrische Eigenschaften hängen von der Elektronenzahl des Clusters ab:
Hat der Cluster 24 Elektronen, wie z.B. in (Mo4Ru2)Se8
(Bilanz: 4*6 (Mo) + 2*8 (Ru) - 2*8 = 24),
ist also elektronenpräsize,
dann entspricht jedes Elektronenpaar einer Oktaederkante, die Verbindungen sind normale Halbleiter.
Hat der Cluster dagegen nur 22 Elektronen, wie z.B. in der Stammverbindung
Pb2+[Mo6S8] (Bilanz: 6*6 - 2*8 + 2 = 22)
dann hat das System zu wenige Elektronen und ist ein guter elektrischer Locher-Leiter
und hat die o.g. supraleitenden Eigenschaften.
Die Struktur besteht als Grundbaueinheit aus einem Würfel [Mo6X8].
Zwischen den Clustern bestehen S-Mo-Wechselwirkungen, die Mo-Kationen
haben eine 4+1-Umgebung aus Sulfid-Ionen. Pb ist reversibel austauschbar
und damit auch die Ladung des Clusters variabel.
 |
| Abb. 9.6.9. Kristallstruktur
der Chevrell-Phase PbMo6S8
‣VRML |
Mo in der Biosphäre
Molybdän ist ein essentielles Element und in einer Reihe interessanter biochemischer
Prozesse beteiligt. Es wird daher auch in Düngemitteln benötigt.
Der Mensch enthält 0.07 mg Mo/kg Körpergewicht.
Molybdän ist in vier Basis-Enzym-Reaktionen beteiligt:
- N2 + 3 H2 ⟶ 2 NH3 (Nitrogenase)
- NO3- ⟶ NO2- + (O) (Nitratreduktase)
- SO42- ⟶ SO32- + (O) (Sulfatreduktase)
- HCOOH ⟶ HCHO + (O)
Die Reaktion 1 ist auch als 'Stickstofffixierung' bekannt und extrem interessant.
Mit Hilfe dieser Reaktion können Blaualgen und Knöllchenbakterien
N2 zu NH3 umsetzen.
Es handelt sich um ein sehr oxidations- und luftempfindliches Enzym.
In einem Katalyse-Zyklus läuft die folgende Brutto-Reaktion ab:
N2 + 8 H+ + 8 e- ⟶ 2 NH3 + H2
Warum dabei H2 entsteht in unklar.
Das Gesamtenzym (s. PDB-Datei unten) besteht aus zwei gleichen Untereinheiten
mit jeweils drei Untereinheiten.
In der γ-Untereinheit mit zwei ADP-Einheiten sorgt für den Antransport von e-.
e- gegen an ersten Fe8S8 (P)-Cluster
Die eigentliche Reduktion erfolgt in der doppelten α/β-Untereinheit
- P = Fe8S8 leitet e- weiter
- Fe-Mo-Coenzym (FeMoco)
N2 bindet an Mo
(Modellsystem mit Cluster + N3-Ligand)
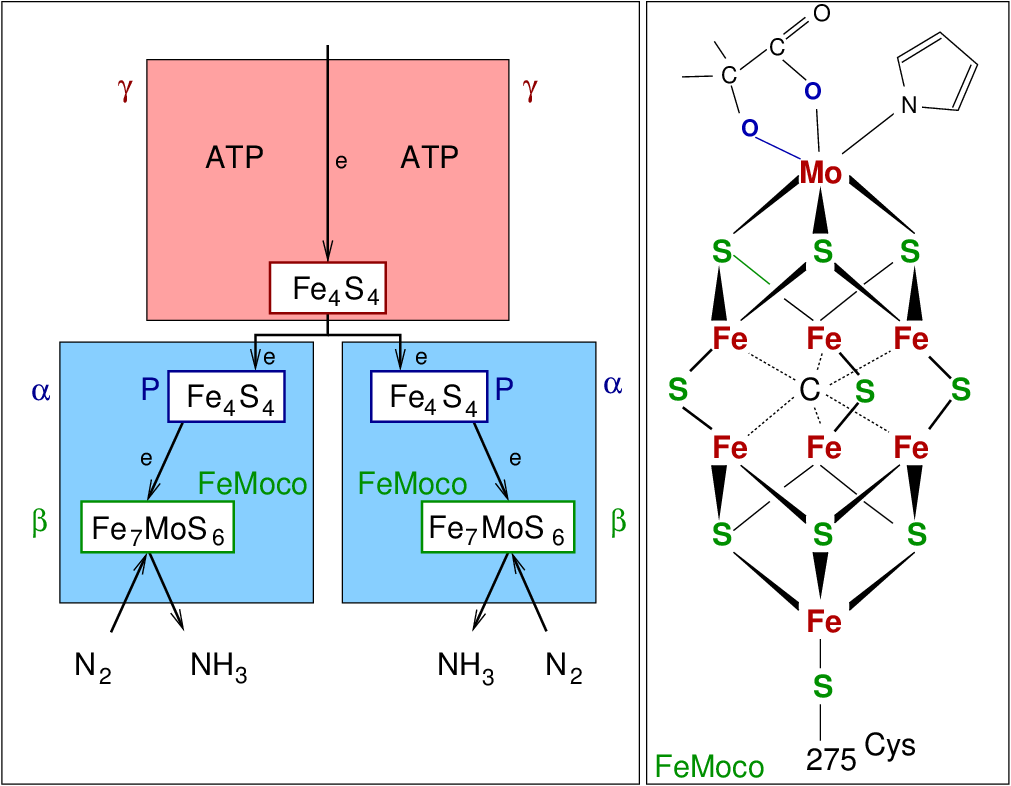
|
| Abb. 9.6.10. Nitrogenase
‣SVG
|
Niedere Oxidationsstufen des Mo
Reduktion von Molybdatlösung mit Zn/HCl erhält man das braune
Mo^{III}-Ion.
Beim Verdünnen von MoIII + MoO42- entsteht in
Lösung grün MoIV
3) mehr MoO42- ⟶ MoV (tiefblau)
Die Chloride von Molybdän sind für alle Oxidationsstufen bekannt:
MoCl2, MoCl3, MoCl4, MoCl5, mit
Fluorid wird auch noch das Hexahalogenid MoF6 gebildet.
Komplexe von Mo0 und MoI
sind nur mit pi-bindenden Liganden wie CO oder C5H5)
stabil. Das Dichlorid MoCl2 enthält Cluster
[Mo6Cl8]4+.
Die Halogenid-Liganden X befinden sich über jeder Fläche
(vgl. dagegen die Nb-Cluster in [Nb6X12]2+,
wo die X-Liganden über jeder Kante gebunden sind.)
Me6 hat immer 40 Elektronen ??
Clusterverbindungen: Mo-Mo-Bindungen (d.h. Metall-Metall-Bindungen)
[Mo6Cl8]4+ reagiert als ganzes - 4 Cl-
reagieren unabhängig, d.h. MoCl2 =
Mo6Cl12).
Vers: Mo^{III}:
K3MoCl6 - K3[Mo(NCS)6], Darstellung aus Molybdat und Rhodanid
Zn ⟶ K3[Mo(NCS)6] (rot) extrahierbar in "Ather
weitere Komplexe: [Mo(phen)3]3+, [Mo(dipy)2]3+ u.a.
MoIV-Komplexe meist labil: K2[MoCl6], Na2[MoF6]
dagegen: [MoIV(CN)8]4- sehr beständig (KZ 8)
MoV: [MoVCl6]-
Iso- und Heteropolysäuren
Isopolysäuren: Mo2O72- und höher: (MonO3n-12-
entstehen beim Versetzen von MoO3 mit Säure (vgl. Vanadium)
Struktur: MoO6-Oktaeder mit gemeinsamen Kanten und Flächen
Heteropolysäuren: Stammsäuren: PO43-, SiO44-, AsO43-
anstelle eines O-Atoms O + 3 MoO3 = Mo3O10
Heteropolysäuren: z.B. P(Mo3O104
z.T. schwer lösliche Verbindungen:
(NH4)3AsO4 + 12 MoO3 ⟶
(NH4)3[AsMo12O40
Allgemeine Formeln der Heteropolymolybdate:
- 1:12 [XMo12O40]n-
- 1:11 [XMo11O39]n-
- 1:10 [XMo10O40]n-
- 1:6 [XMo6O24]n-
mit X = As, P, Si, I.... Strukturen und viele Anwendungen und Eigenschaften
dieser interessanten Verbindungsklasse (heute: POMs = Polyoxometallates) liest man am besten
in meinem alten PDF zum Vortrag Heteropolysäuren
(der aufgemotzte Habil-Vortrag ;-) ) nach
Wolfram
Vorkommen und Gewinnung
Wolfram kommt als Wolframit, (Mn,Fe)WO4 (nur Mn: Hübnerit, s. Foto in Abb. 9.6.11; nur Fe: Ferberit),
und Scheelit, CaWO4 (s. Abb. 9.6.11 links, nach Carl Wilhelm Scheele, 1742-1786), in der Natur vor.
Scheelit zeichnet sich durch eine bläuliche Fluoreszenz bei Bestrahlung mit kurzwelligem UV-Licht aus
und kann auf diese Weise leicht detektiert werden (s. Video).
| ⚗ Prospektierung von Scheelit mittels UV-Lampe
(22MB|MP4|H264) |
|
Wolfram ist etwas gleich häufig wie Kupfer, der durchschnittliche W-Gehalt in der
Lithosphähre beträgt 69 g/t.
 |
 |
| Abb. 9.6.11. Ein pseudooktaedrischer Kristall von Scheelit,
CaWO4 (links) und von Hübernit (MnWO4) |
Zum Abbau von Scheelit, der sich beim aktuellen Wolfram-Preis von 42 Dollar/kg (30.10.2014) noch bei einem Gehalt von
unter 1 % Wolfram sogar unter Tage wieder lohnt, sei auf die Web-Seiten der österreichischen Firma Wolfram in Mittersill
und auf ein Video verwiesen. Die Anreicherung erfolgt mittels Flotation. Haupterzeuger ist China
mit einem Weltmarktanteil von 80 %. Ca. 50 % des produzierten Wolframs kommen aus Recycling-Wolfram.
Zur Darstellung des Elementes werden die o. g. Wolframate MWO4
mit festem Na2CO3 in das Na-Wolframat überführt (basischer Aufschluss).
Dieses wird in saurer wässriger Lösung entsprechend:
Na2WO4 + 2 H+ ⟶ WO3 + 2 Na+ + H2O
über 'Wolframsäure'
zum Trioxid umgesetzt. Zur Reinigung kann das Trioxid mit Ammoniak-Lösung versetzt werden
und dann als sog. APT (Ammonium-paratungstate),
(NH4)10[H2W12O42].4 H2O
gefällt werden. In dieser Form ist es auch im Handel erhältlich.
Zur Herstellung des Elementes wird das Trioxid bei 800oC mit Wasserstoff reduziert.
Dabei entsteht das Metall als feines schwarzes Pulver hoher Dichte (Abb. 9.6.12.)
 |
 |
| Abb. 9.6.12. Elementares Wolfram |
Eigenschaften des Metalls
Wolfram hat grosse Ähnlichkeit mit Molybdän.
Es ist extrem hoch schmelzend, der Schmelzpunkt beträgt 3410 oC (!!).
Es ist damit (nach Kohlenstoff, der jedoch nicht schmilzt) das Element mit dem höchsten
Schmelzpunkt. Der Siedepunkte beträgt 5555 oC und wird ganz minimal vom
Siedepunkte von Rhenium übertroffen. Elementares Wolfram hat eine hohe
Dichte von 19.26 g/cm3 und kann z.B. zum Fälschen von Goldbarren (W-Kern)
verwendet werden. Weitere Anwendungen, die auf der hohen Dichte beruhen, sind
Gewichte z.B. im Bootsbau oder bei Waffen.
Metallisches α-Wolfram kristallisiert in der b.c.c.-Struktur und
ist auch der Namensgeber für diesen Strukturtyp.
Daneben gibt es eine gelegentlich als 'metastabile β-Form' bezeichnete
'Modifikation', bei der es sich jedoch um die Sauerstoff-stabilisierte Phase W3O, also ein Suboxid, handelt.
Die W-Atome besetzen die Cr-Plätze im Cr3Si-Typ, das supraleitende Material Nb3Sn ist isotyp.
Der Sauerstoff besetzt die Si/Sn-Positionen. Die Struktur, die zur erweiterten Gruppe der Frank-Kasper-Phasen
gehört, ist in Abbildung 9.6.13. gezeigt (s. dazu
auch Kapitel 7.3. der Vorlesung
Intermetallische Phasen).
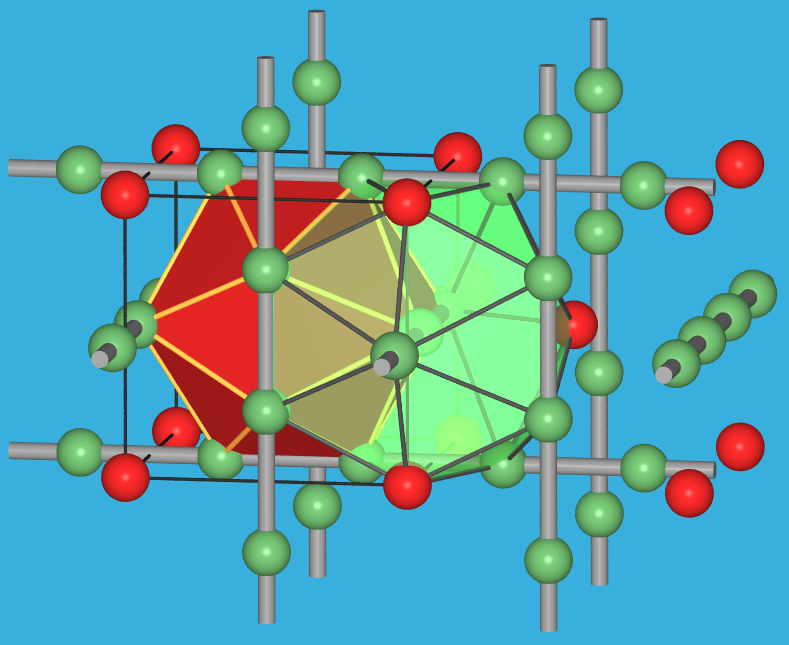 |
| Abb. 9.6.13. Kristallstruktur
von W3O (Cr3Si-Typ)
‣VRML |
Verwendet wird Wolfram aufgrund seines extrem hohen Schmelzpunktes, vor allem in Glühlampen (2-4 % der Weltproduktion
von ca. 72 kt, davon 60 kt/a aus China), als Elektrode beim Schweissen und als Anode von Röntgenröhren.
W-Pulver kann angedickt und durch Zonenschmelzen zum Einkristall gezogen werden.
Ausserdem wird Wolfram Stählen zugesetzt. Das hierzu verwendete Ferrowolfram entsteht
durch gemeinsame Reduktion von Eisenerzen und Wolframoxid mit Kohle im elektrischen Ofen.
Die Hauptanwendung (ca. 85 %) ist jedoch als
sogenanntes 'Hartmetall', s. bei 'Sonstigen Verbindungen' unten.
Obwohl nicht besonders edel, ist elementares Wolfram durch eine Oxidschicht
chemisch recht inert. Es wird erst von einer Mischung aus Salpeter- und Flußsäure gelöst.
Bekannte Oxidationsstufen von Wolfram sind +2, +3, +4, +5 und am häufigsten ist aber +6.
Im Englischen heißt Wolfram 'tungsten' vom 'tung sten' (schwedisch) 'schwerer Stein'.
Halogenide
Die Halogenide sind denen von Molybdän sehr vergleichbar. Iodide gibt es nur in den niedrigen
Oxidationsstufen +2 und +3, alle übrigen Halogenide sind von allen Halogenen bekannt. Im Einzelnen:
Oxide und Oxidometallate
Beim Ansäuern von Wolframatlösungen (s.o. zur W-Herstellung) fällt
die 'Wolframsäure' aus
WO42- + 2 H+ ⟶ WO3 .x H2O
Diese löst sich im Gegegnsatz zu Molybdänsäure nicht im Überschuß von
Säure. Beim Erhitzen von WO3 .xH2O
entsteht das gelbe Trioxid WO3 mit
ReO3-Struktur. Es gibt weitere
Modifikationen von WO3, eine hexagonale Struktur ist in Abbildung 9.6.15. gezeigt. (s. auch bei
den Wolframbronzen unten).
 |
| Abb. 9.6.15. Kristallstruktur
von WO3
‣VRML |
Im H2-Strom lassen sich aus WO3
gemischtvalente Oxide wie z.B. W10O29
(Scherstrukturen, s. auch Kap. 4 der Vorlesung Strukturchemie der Oxide)
und schliesslich WO2 mit
Rutil-Struktur darstellen.
 |
| Abb. 9.6.16. Die Wolfram-Oxide WO3 (oben)
und WO2 (unten) |
Schwerlösliche Wolfram-Verbindungen sind (Versuche):
- WO42- + Pb2+ ⟶ PbWO4
- WO42- + 2 H+ + H2S ⟶ WS3 + 4 H2O
Wolfram bildet ähnlich wie Molybdän zahlreiche Iso- und Heteropolyanionen bzw. Säuren.
Bei pH=6 kondensiert das nur im alkalischen stabile isolierte tetraedrische WO42--Ion zunächst zu
[HW6O21]5- und schliesslich zum Parawolframat, [H2W12O42]10- (s.o.).
Bei pH=4 bildt sich dann langsam das bekannte Polyanion mit α-Keggin-Struktur,
[H2W12O40]8-.
Dieses enthält anstelle des PV-Kations im Zentrum des Heteropolyanions
[PW12O40]3- zwei Protonen.
Der weitere Aufbau aus zwölf über Kanten und Ecken verknüpften
WO6-Oktaedern ist vergleichbar.
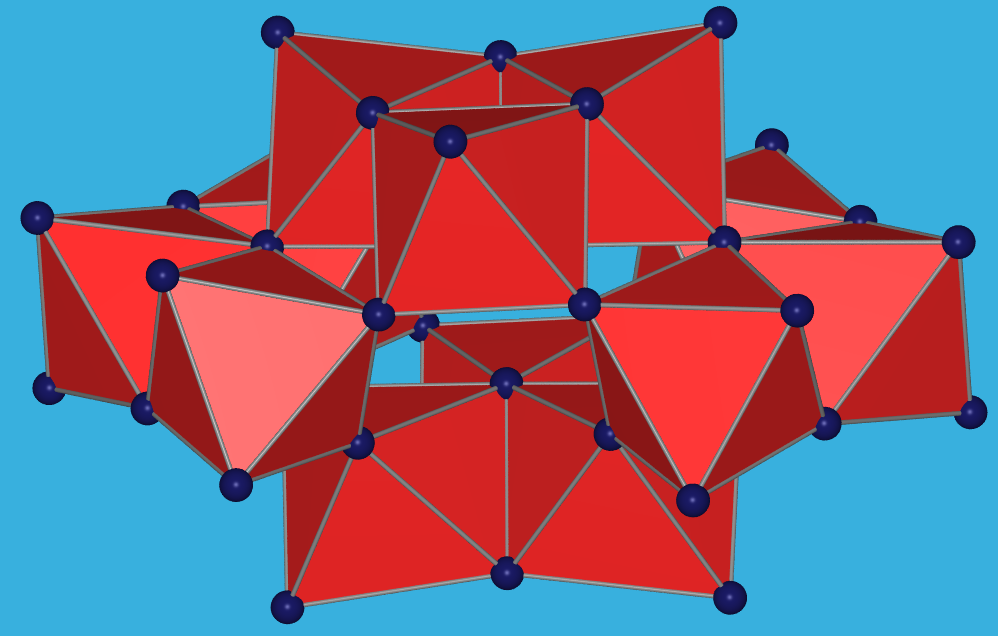 |
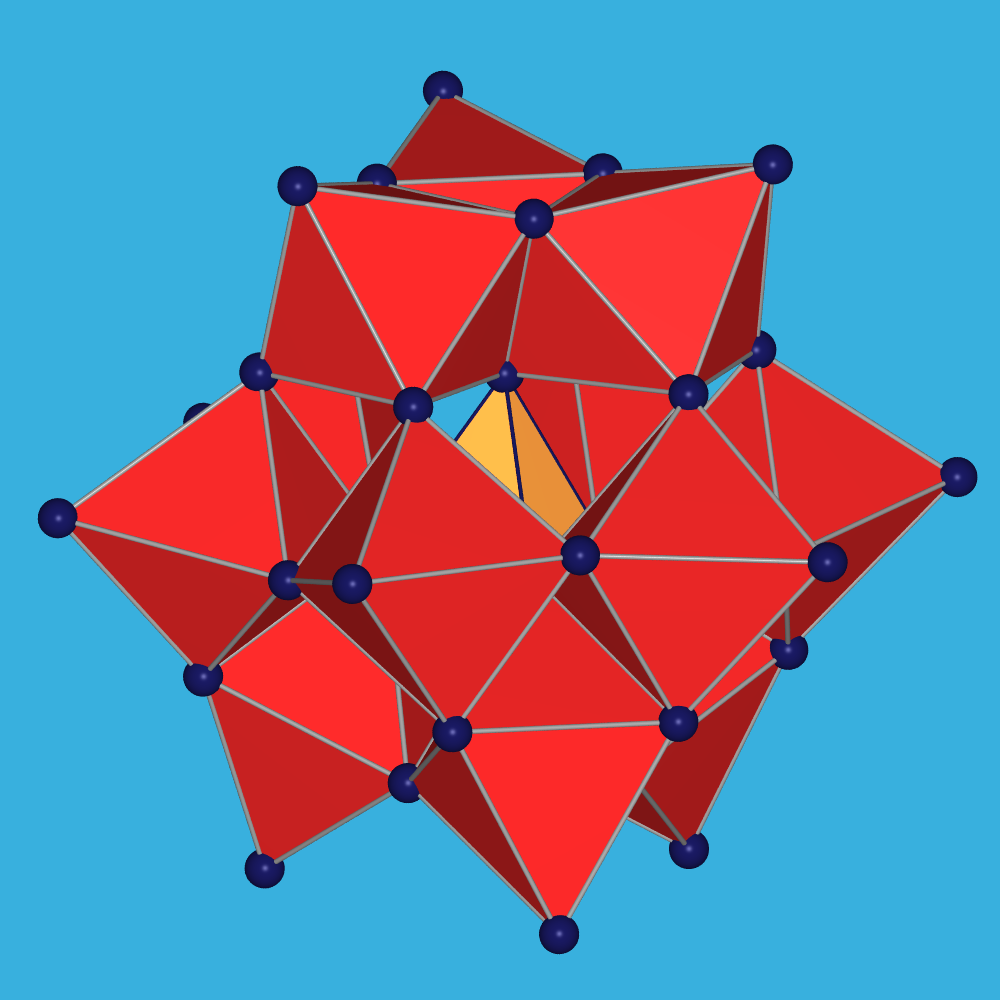 |
| Abb. 9.6.17. Strukturen
des Parawolframat- (links) des Keggin-Ions (rechts, hier gefüllt, z.B. mit einem PO4-Tetraeder)
‣VRML-I
und
‣VRML-II
|
Als Wolframblau bezeichnet man die extrem komplexen O/OH-haltigen gemischtvalenten Spezies
(allgemein WO3-x(OH)y inkl. div. Anionen),
die sich in Lösung bilden, wenn eine Wolframat(VI)-Lösung mit Zn/HCl reduziert wird:
| ⚗ Reduktion von Wolframat(VI)
(38MB|MP4|H264) |
|
Ebenfalls gemischtvalent sind die sog. Wolframbronzen, blauviolette bis metallisch-goldgelb
glänzende nichtstöchiometrische Feststoffe, die sich aus Natriumwolframat durch Reduktion mit H2,
Natrium oder Wolfram herstellen lassen.
 |
| Abb. 9.6.18. Zwei verschiedene Wolframbronzen |
Die Eigenschaften und die Strukturen sind abhängig vom Natrium- bzw. Alkalimetall-Gehalt x
in NaxWO3.
Von x=1 bis x=0.3 kristallieren die Na-Wolframbronzen in der Perowskitstruktur.
halbmetallische Eigenschaften, gute Leitfähigkeit (Elektronenleitung)
unlöslich in Wasser und Säuren
Struktur: Verknüpfung von Oktaedern wie im WO3, dazwischen Alkali-Ionen
 |
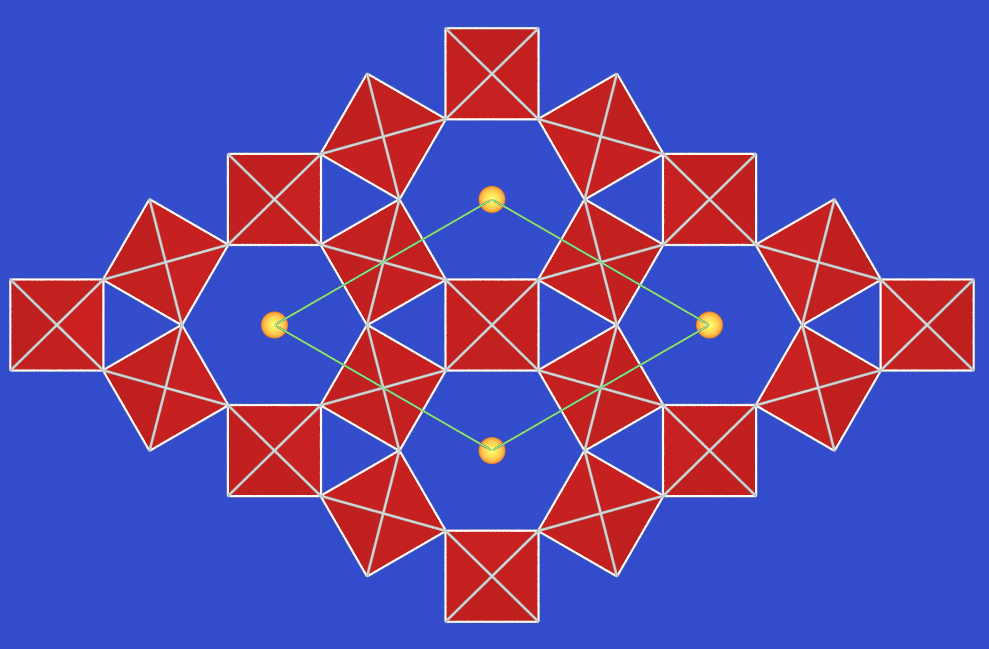 |
| Abb. 9.6.19. Kristallstrukturen
einer tetragonalen und einer hexagonalen Wolframbronze
‣VRML-I
und
‣VRML-2 |
Sonstige Verbindungen
Mit Bor, Kohlenstoff, Silicium und Stickstoff bilden sich (z.T. nichtstöchiometrische)
Einlagerungsverbindungen, am bekanntesten ist davon das WC, sog. Widia (= wie Diamant, bezogen auf seine Härte).
WB2 und WSi2 kristallisieren im
AlB2-Strukturtyp; die Strukturen enthalten also plane Sechsecknetze
aus B-Atomen (vgl. Graphit).
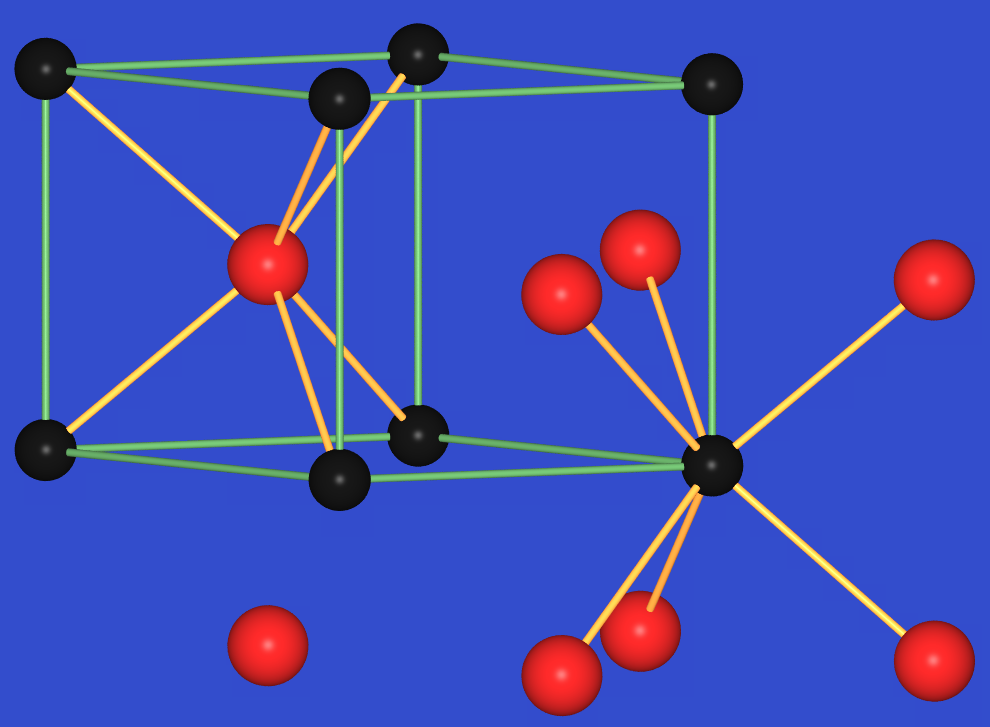
WC hat eine besondere, vergleichweise seltene Struktur (Abb. 9.6.20): Die W (und die C-Atome) bilden eine hexagonal
primitive Packung. Die C-Atome besetzen die Hälfte der trigonalen Prismen in dieser Packung. Letztlich
sind dadurch die W-Atome trigonal-prismatisch von C-Atomen umgeben (s.u. zu Wolfram-Komplexen mit dieser
geometrischen Anordnung). Umgekehrt sind auch die C-Atome in trigonalen Prismen aus Wolfram-Atomen
zu finden (6+6-Koordination).
WC ist das mit Abstand wichtigste Wolfram-haltige Material. Etwas 90 % des Wolframs werden
entsprechend weiterverarbeitet.
WC weist eine Härte von 8-9 auf, ist warmfest und schmilzt erst bei 2780 oC.
Zur Herstellung von sog. Hartmetall-Werkzeugen wird
ein feines Pulver von WC (ca. 0.5 bis 5 μm) mit ca. 10 % Cobalt
bei Temperaturen von XXX und Drücken von XXX pulvermetallurigsch verarbeitet. Die Abbildung 9.6.21 zeigt
einen Fräser und Wendeschneidplatten aus diesem Hartmetall 'Widia' (Dank an unsere Werkstatt!). Zusätzlich
sind die meisten Werkzeuge heute oberflächlich weiter durch Metallnitrid-, -carbid- oder -borid-Beschichtungen
gehärtet. Der in Abb. 9.6.21 gezeigt Fräser z.B. hat zusätzlich eine Beschichtung aus 'TiAlCN'.
 |
 |
| Abb. 9.6.20. Kristallstruktur von WC
‣VRML |
Abb. 9.6.21. Hartmetallwerkzeuge (Fräser, Wendeschneidplatten) |