Vorlesung Chemie der Metalle
9. Übergangsmetalle II
V. Nebengruppe/5. Gruppe/Vanadium-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel:
- Allgemeines
- Vanadium
- Vorkommen
- Element und seine Gewinnung
- Oxide
- V in wässriger Lösung, Isopolyvanadate
- Halogenide
- Komplexe
- Niob und Tantal
- Vorkommen
- Metall: Darstellung und Verwendung
- Oxidometallate und Komplexverbindungen
- Oxide
- Halogenide
- Intermetallische Phasen
Allgemeines
Die höchste Oxidationsstufe aller Elemente der Vanadium-Gruppe
ist +V. Zusätzlich ist bei Vanadium selber noch +IV sehr wichtig,
ebenfalls noch bekannt ist V(II) und V(III). Bei Niob
und Tantal, die wegen der Lanthanoidenkontraktion sehr ähnliche Radien
haben und damit chemisch auch sehr ähnlich sind,
sind ebenfalls +II, +III und +IV wichtige Oxidationsstufen neben +V.
Entsprechend der generellen Tendenz in den Nebengruppen ist
bei Nb und Ta die hohe Oxidationsstufe +V stabiler als bei Vanadium.
VV wirkt - im Gegensatz zu TiIV - bereits oxidierend.
Vanadium
Vorkommen
Vanadium ist ein Begleiter in vielen Eisenerzen. Reine Vanadium-Minerale sind selten,
eine Ausnahme hiervon ist der zu Apatit isotype
Vanadinit Pb5[VO4]3Cl (Abb. 9.5.1.) sowie der Patronit V(S2)2,
ein V(IV)-Disulfid.
.
 |
| Abb. 9.5.1. Vanadinit Pb5[VO4]3Cl
|
Metall
Das metallische Element Vanadium ist dem Stahl sehr ähnlich,
es ist durch eine Oxidschicht passiviert.
Die Darstellung kann nach drei unterschiedlichen Verfahren erfolgen:
- Reduktion von V2O5 mit elementarem Calcium.
- Vanadiumhaltige Stähle entstehen direkt bei der Reduktion der V-haltigen
Eisenerze mit Kohle.
- Zur Reindarstellung von Vanadium kann das van-Arkel-Verfahren benutzt werden,
bei dem eine chemische Transportreaktion von VI2 ?? oder ?? VI5
ausgenutzt wird.
Verwendung findet Vanadium in Form von Ferrovanadin, einer Legierung aus 50 % Eisen
und 50 % Vanadium, das für Spezialstähle eingesetzt wird.
 |
| Abb. 9.5.2. Vanadium-Blech |
Oxide
Von Vanadium sind eine Vielzahl von Oxiden bekannt:
(zur Übersicht aller Metall-Oxide allgemein s. Kap. 8.5.)
- VOx mit x = 0.9 bis 1.2 ist grau und kristallisiert
im NaCl-Typ.
- Das schwarze Oxid V2O3 hat Korund-Struktur.
- VO2 hat einen Homogenitätsbereich
VOx mit x = 1.8 bis 2.0 und kristallisiert in der
Rutil-Struktur. Wegen der vorliegenden Gemischtvalenz ist es blauschwarz.
- Das braunrote Oxid V2O5
ist das beständigste der Reihe und als Katalysator bei der
Schwefelsäure-Herstellung bekannt (s.u.).
Es kristallisiert in einer eigenen Struktur, die
aus Schichten quadratischer [VOO4]-Pyramiden besteht (Abb. 9.5.3.).
Der kurze V-O-Abstand zur Spitze der Pyramide beträgt nur 154 pm,
die Basisatome der Pyramide haben einen Abstand von 180-200 pm zu V.
Ein weiteres Oxid-Ion (gestrichelte Linien) befinde sich 280 pm
unterhalb der quadratischen Basisfläche. Man kann diese Struktur
damit auch als Scherstruktur des ReO3-Typs ansehen, wobei
die Oktaeder allerdings deutlich verzerrt sind.
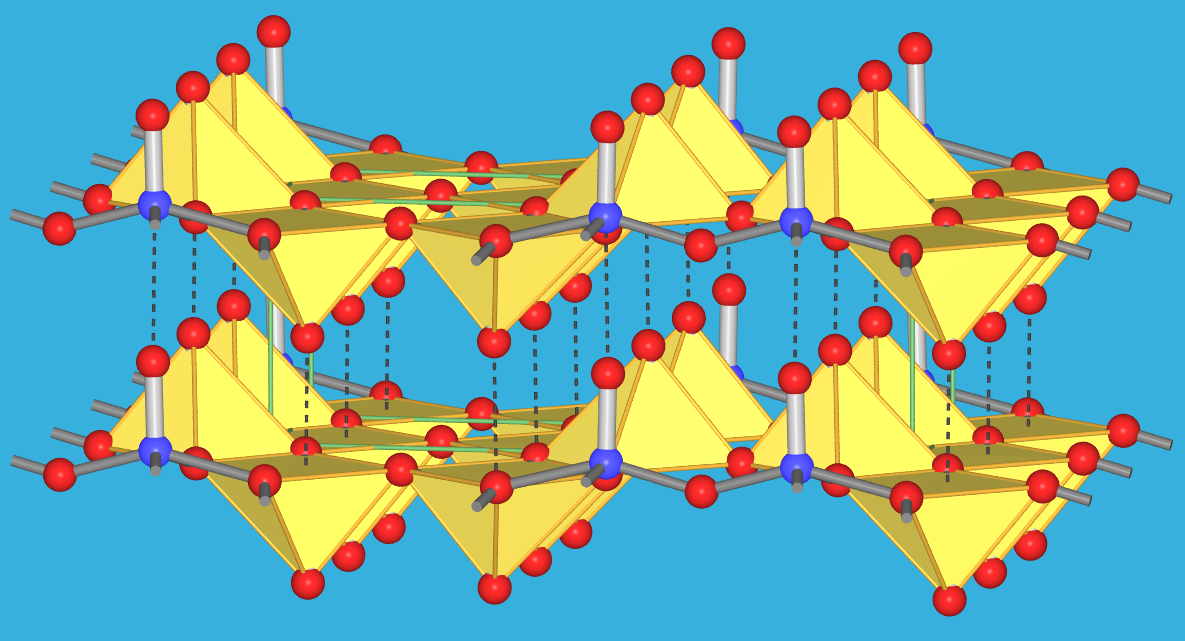 |
| Abb. 9.5.3. Struktur von V2O5
‣VRML |
Vanadium in wässrigen Lösungen
Vanadium bildet in wässrigen Lösungen eine große Zahl unterschiedlicher
Oxidationsstufen, die jeweils vorliegenden Ionen bilden farbige Komplexe, d.h.
bei den Redoxreaktionen treten die verschiedensten Farben auf. Die in saurer Lösung
stabilen Spezies und ihre Farben sind:
- V2+, blassviolett, als Hexaquakomplex, d3, Spinerlaubt
- V3+, blassgrün, ebenfalls noch als Hexaquakomplex, d2, Spinerlaubt
- VIVO2+, blau, als [VIVO(H2O)5]2+
- VVO2+ (gelb, als [VV(O)2(H2O)4]+)
Bei der sukzessiven Oxidation von Vanadium kommt es daher zu einem
Farbeffekt von blauviolett über grün(blau) nach gelb.
Im Pourbaix-Diagramm (Abb. 9.5.4.) sind pH-abhängig die stabilen
Spezies für die verschiedenen Oxidationsstufen ablesbar:
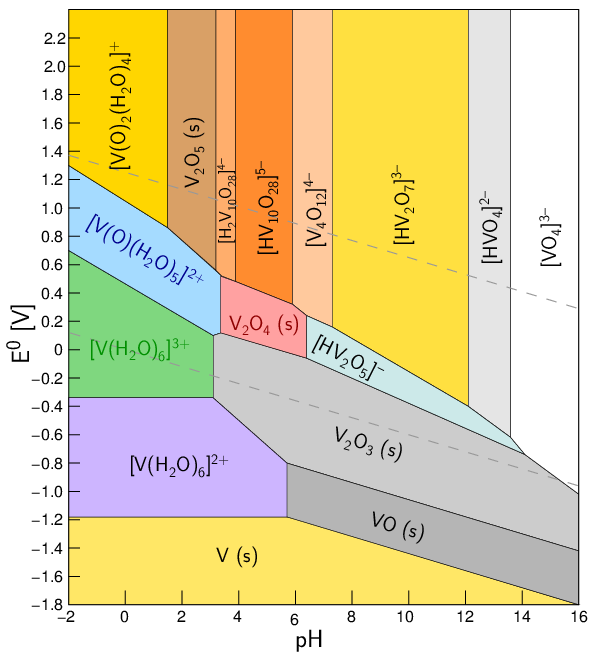 |
| 9.5.4. Pourbaix-Diagramm von
Vanadium.
|
Die stabilste Oxidationsstufe in wässrigen Medium ist VIV.
VIII wird durch Sauerstoff oxidiert, VV sehr leicht reduziert.
VII reduziert Wasser zu Wasserstoff.
Versuch: Auflösung von elementarem Vanadium in oxidierenden Säuren wie z.B HNO3:
6 V + 10 HNO3 ⟶ 3 V2O5 + 10 NO + 5
H2O
V2O5 + 2 HNO3 ⟶ 2 (VO2)NO3 + H2O
V2O5 ist in Wasser unlöslich, löst sich aber sowohl in Laugen als auch
in Säuren.
Versuche:
V2O5 + 6 NaOH ⟶ 2 Na3VO4 + 3 H2O
V2O5 + 6 HCl ⟶ 2 VOCl2 (blau) + Cl2 +
3 H2O
V2O5 + H2SO4 ⟶ (VO2)2SO4
Mit Wasserstoffperodixd entsteht wie bei den Nachbarelementen Titan und Chrom ein Peroxovanadyl-Kation:
VO2+ + H2O2 + 2 H+
⟶ [V(O2)]3+ + 2 H2O
Isopolysäuren
Isopolysäuren enthalten kondensierte VOx-Polyeder.
In den Isopolysäuren liegt stets VV vor. Ihre Bildung kann bei der Umsetzung
einer Vandat(V)-Lösung mit halbkonzentrierter H2SO4 beobachtet werden.
Abhängig vom pH-Wert liegen unterschiedliche Spezies vor, die sich auch durch ihre Farben unterscheiden.
gelb ⟶ orange ⟶ Aufhellung zum hellgelbem VO2+ (s. Versuch unten).
H3VO4 ⟶
H4V2O7 ⟶
H3V3O7 ⟶
H6V10O28
(HVO4)2- ⟶
(HV2O7)3- ⟶
(V3O9) ⟶
(V10O28)6- ⟶ VO3+ ⟶
(HV10O28)5-
Bei stark alkalischen pH-Werten (z.B. 13) liegen demnach einfache Vanadate vor,
Polyvanadate entstehen im pH-Bereich zwischen 8 bis 6 und in sauren Lösungen
gibt es dann 'Vanadyl'verbindungen vor.
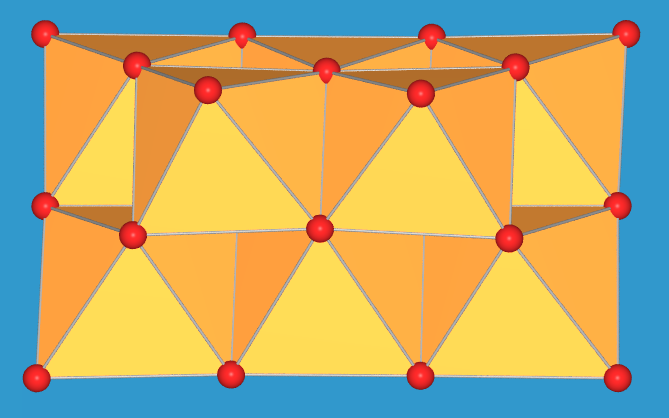 |
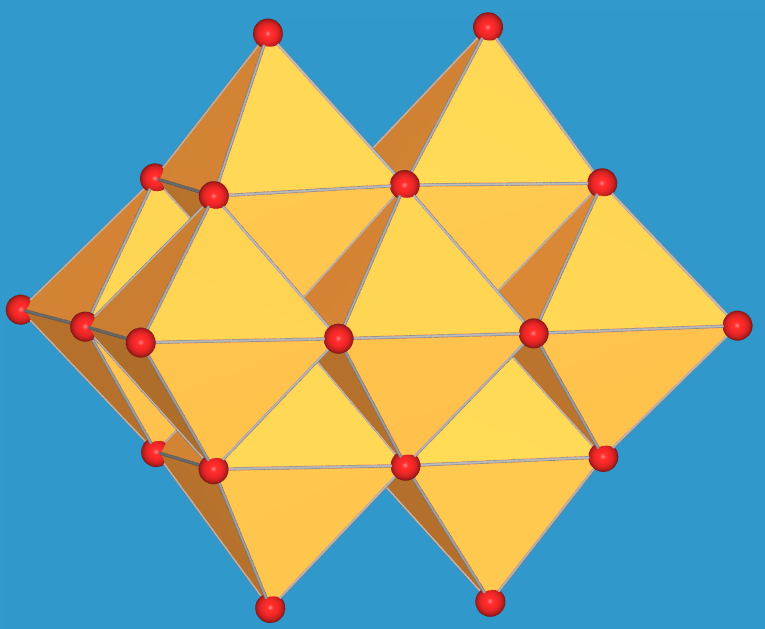 |
| Abb. 9.5.5. Der Cluster
[V10O28]6- in zwei verschiedenen Ansichten
‣VRML |
| ⚗ pH-Abhängigkeit der Oxido/Hydroxido-Metallat-Spezies am Beispiel von V(V)
(105MB|MP4|H264) |
|
|
Beim Auflösen von rotbraunem V2O5 in hochkonzentrierter
Natronlauge und anschliessendem Verdünnen liegen zunächst
farblose VO43--Ionen vor. Bei langsamer Zugabe
von halbkonzentrierter Schwefelsäure entsteht noch im basischen
das hellgelbe Divanadat-Ion V2O74- (vgl. Chromat/Dichromat-Gleichgewicht).
Im Bereich neutraler pH-Werte entstehen durch Kondensation die orangenen Isopolysäuren
wie z.B. das Decavanadat [V10O28]6-. Bei
sehr kleinen pH-Werten liegt schliesslich das gewinkelt gebaute Vanadyl-Kation als
Wasserkomplex [VV(O)2(H2O)4]+
vor, das wieder hellgelb ist.
|
Ähnliche Isopolysäuren sind nicht nur von Vanadium, sondern auch von den Elementen
Nb, Ta, As, Cr, Mo, W, Si, P bekannt.
Schwerlösliche Vanadate sind Ag3VO4,
Pb3(VO4)2 und Ba3(VO4)2.
Eine sehr wichtige Vanadium-Verbindung ist auch Bismutvanadat, BiVO4, ein hochpreisiges aber
sehr brilliantes und vor allem im Vergleich zu CdS untoxisches Gelbpigment (s. Abb. 9.5.6).
 |
| Abb. 9.5.6. Gelbpigment BiVO4 (Klinobisvanit-Modifikation) |
In alkalischer Lösung können durch Einleiten von Schwefelwasserstoff aus den Oxido- die
entsprechenden Sulfidovanadate dargestellt werden:
VO43- + 4 H2S ⟶ VS43- + 4 H2O
2 VS43- + 6 H+ ⟶ V2S6 + 3 H2S
Mit Zn/HCl oder elektrolytisch kann Vanadium schrittweise reduziert werden:
VV (gelb) ⟶ Mischfarbe grün ⟶
VIV (blau) ⟶ VIII (grün) ⟶
VII (blassviolett)
| ⚗ Reduktion von V(V) mit Zn
(225MB|MP4|H264) |
|
|
Vanadium(V) kann mit Zink im Sauren stufenweise reduziert werden:
[VV(O)2(H2O)4]+ (gelb) ⟶
[VIV(O)(H2O)5]2+ (blau) ⟶
[VIII(H2O)6]3+ (grün) ⟶
[VII(H2O)6]2+ (violett)
Diese vierstufige Redoxreaktion ist auch Basis von sogenannten 'Redox-Flow'-Batterien,
die als vergleichweise billige und einfache stationäre Speicher elektrischer Energie genutzt werden. In der Abbildung
sind die Entladevorgänge gezeigt.
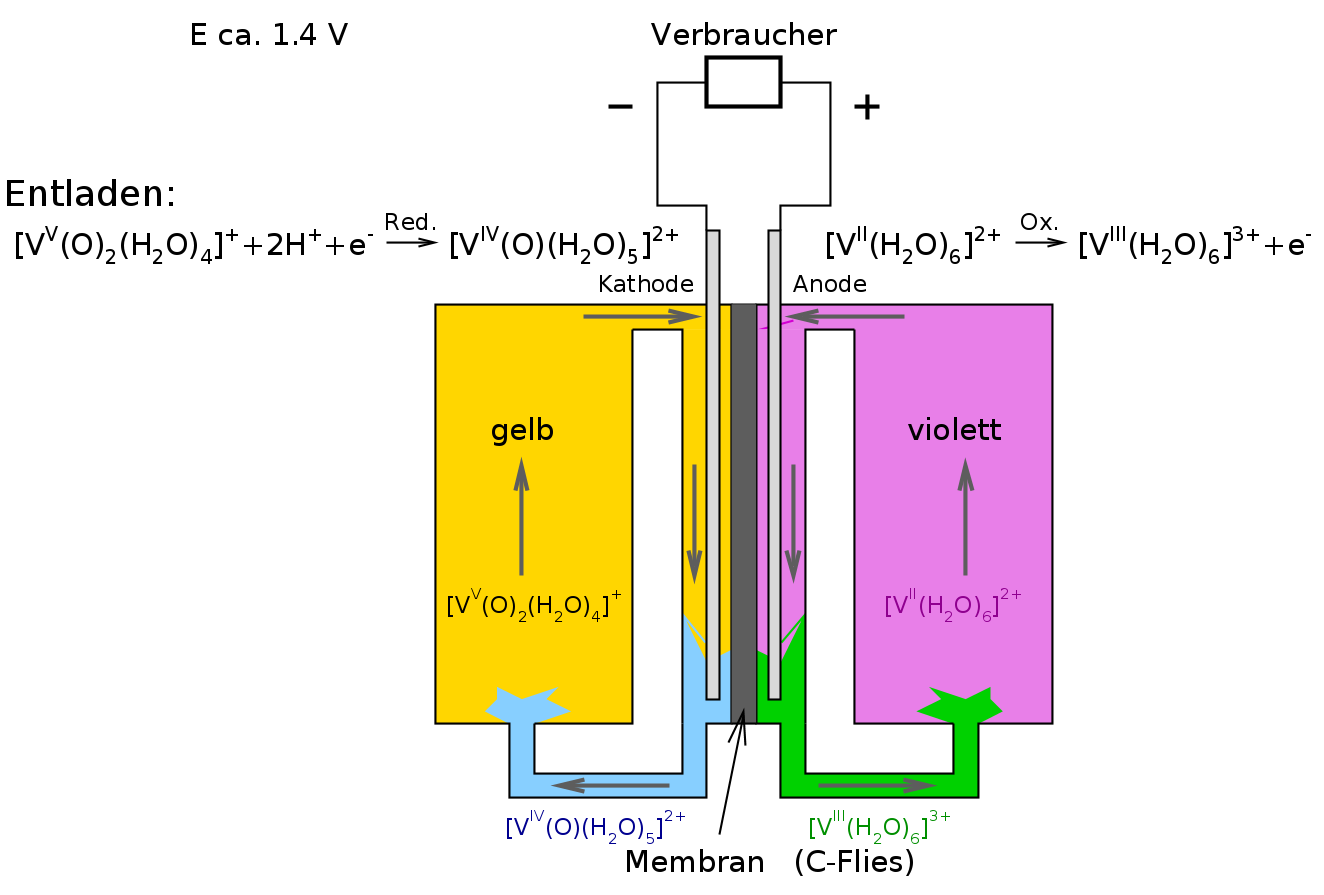
Prinzip der Vanadium 'Redox-Flow'-Batterie
‣SVG
|
Eine elektrolytische Reduktion verläuft vergleichbar.
Weitere Reduktionsreaktionen sind:
- VV2O5 + Na2SO3
⟶ 2 VO2IV + Na2SO4
- VOIV2 + H2SO4 ⟶
VOIV(SO4) + H2O
und die für die Schwefelsäure-Herstellung wichtige katalytische Wirkung von V2O5:
- V2O5 + SO2 ⟶ V2O4 + SO3
- V2O4 + 1/2 O2 ⟶ V2O5
V(IV) bildet im alkalischen charakteristische Cluster [VIV18O42]12-
mit quadratischen Pyramiden als Grundpolyedern:
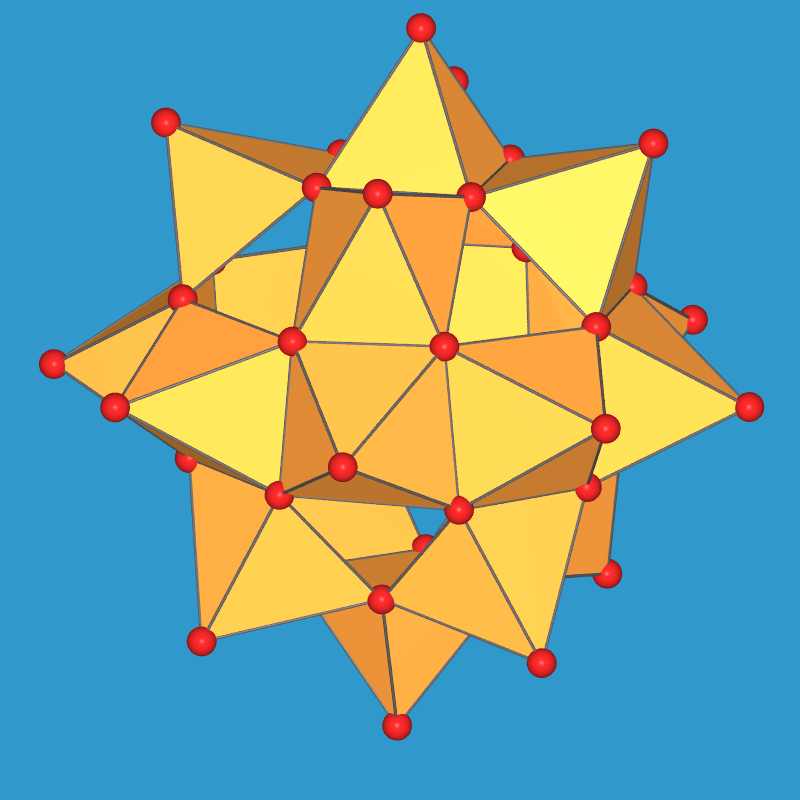 |
| Abb. 9.5.7. Der (hier leere) Cluster
[VIV18O42]12-
‣VRML |
Halogenverbindungen
Wichtige Halogenverbindungen (allgemeine Übersicht in Kap. 8.4.)
von Vanadium sind:
- VF6
- VOF3, VOCl3, VOBr3
- VCl4, VBr4, VI4 (nur in der Dampfphase)
- VF3, VCl3
- VF2
Komplexe
Von Vanadium(0) gibt es den Carbonylkomplex V0(CO)6
der ein 17 Elektronensystem ist und damit eine Ausnahme von der
sonst bei den Carbonylkomplexen geltenden Edelgasregel darstellt.
Niob, Tantal
Vorkommen
Niob und Tantal kommen in der Natur immer gemeinsam vor, da
sie aufgrund der Lanthanoidenkontraktion praktisch gleiche Ionenradius aufweisen.
Ein wichtiges Mineral ist der Tantalit (Fe,Mn)(Nb,Ta)2O6.
Darstellung
Die Elemente können durch Reduktion der Oxide mit Aluminium oder Kohlenstoff erhalten werden.
 |
| Abb. 9.5.8. Niob-Blech |
Verwendung
Tantal ist wegen seines hohen Schmelzpunktes von 2850 oC und seiner dem Stahl
ähnlichen mechnischen Eigenschaften als Hochtemperaturwerkstoff (Flugzeugbau, Kanonenrohre, Tiegel)
einsetzbar.
Niobate und Komplexverbindungen des Nb
Beim Auflösen und Aufschliessen von Niob- oder Tantaloxid in alkalischen Medien werden lösliche
Niobate/Tantalate gebildet:
Nb2O5 + 6 KOH ⟶
2 K3NbO4 + 3 H2O
Beim Ansäuern entsprehender Lösungen entstehen die gelartigen freien Säuren (vgl. H4SiO4):
K3NbO4 + 3 HCl ⟶
(H3NbO4) + 3 KCl
Neben den Oxidometallaten kennt man auch entsprechende Fluoridometallate, wie z.B. das
stabile Heptafluoridoniobat (ein typischen Beispiel für einen Komplex mit
sieben Liganden):
(H3NbO4) + 7 F- + 5 H+
⟶ [NbF7]2- + 4 H2O
(H3NbO4) + 2 C2O42- + 5 H+ ⟶
[Nb(C2O4)4]3- + 4 H2O
K3NbO4 + 3 Na+ ⟶ Na3NbO4 + 3 K+
Oxide
Die wichtigsten Oxide von Niob und Tantal sind die Pentoxide (Nb2O5).
Außerdem sind aber auch niedere Oxide wie NbO (Defekt-Kochsalz-Struktur mit
Nb6-Clustern), Nb2O3 und NbO2 bekannt.
Halogenide
Nb- und Ta-Halogenide sind oft dimer oder polymer (Cluster).
NbF5 liegt als Tetrameres vor, vier Oktaeder sind zu einem Ring verknüpft.
NbCl5 ist dimer, zwei Oktaeder sind über eine Kante verknüpft.
Wichtige Clusterverbindungen mit den Halogenen X sind z.B.
[Nb6X12]2+, in denen Nb6-Oktaeder
vorliegen, in denen sich je ein Halogenid X über jeder Kante befindet
(s. auch Kap. 8.6. Clusterverbindungen).
Niob bildet wie Vanadium mit H2O2 einen Peroxidokomplex:
H3NbO4 (farblos) + H2O2
+ 3 H+ ⟶ [Nb(O2)]3+ (gelb) + 4 H2O
Intermetallische Phasen
Eine wichtige Verbindung des Niobs ist Nb3Sn, eine supraleitendes Material mit
einer Sprungtemperatur von ca. 35 K, das zur Herstellung von Spulen von starken Magneten (z.B. in
NMR-Spektrometern) verwendet wird. Zur Struktur (A15-Typ)
siehe HIER.










